题目内容
【题目】化学与生活密切相关。
Ⅰ.每100克巧克力中营养成分的含量如下表。
蛋白质/g | 脂肪/g | 糖类/g | 矿物质/mg | 维生素B/mg | 维生素C/mg | 总能量/千焦 | ||
5 | 32 | 51 | 钙 | 铁 | 磷 | 0.2 | _____ | 2142 |
50 | 4 | 120 | ||||||
(1)表中缺少人体必需的六大营养素中的____,2142千焦能量全部来自糖类吗?____(填“是”或“不是”)。
(2)摄入_____(填元素符号,下同)元素不足会导致骨骼疏松,易得佝偻病。钙、铁、磷元素中属于人体必需微量元素的是____。
Ⅱ.水是生命之源。请回答下列问题:
(1)构成水的粒子可表示为________(填序号)。
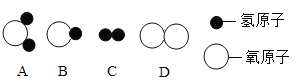
(2)下列物质加入水中能形成乳浊液的是________。(填序号)
A 粉笔灰 B 蔗糖 C 植物油
(3)硬水是指含有较多________、________(填微粒符号)的水。生活中,常用________鉴别硬水和软水。
(4)如图为电解水的实验装置图,下列说法正确的是________。
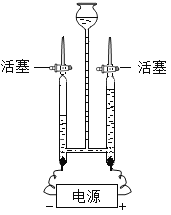
A 根据该实验所得产物,说明水分子可分
B 在水中加入少量稀硫酸以增强水的导电性
C 该实验中所得氢气和氧气的质量比约为2:1
D 与正极相连的玻璃管内得到的气体能使带火星的木条复燃
【答案】水 不是 Ca Fe A C Ca2+ Mg2+ 肥皂水 ABD
【解析】
Ⅰ.(1)人体需要的六大营养素是糖类、油脂、蛋白质、维生素、水和无机盐(矿物质),表中缺少人体必需的六大营养素中的水。食物中能量来源于有机物:糖、蛋白质、脂肪,并非全部来自糖类。
(2)摄入钙(Ca)元素不足会导致骨骼疏松,易得佝偻病。钙、铁、磷元素中铁(Fe)属于人体必需微量元素,钙、磷是常量元素。
Ⅱ.(1)构成水的粒子是水分子,水分子化学式为H2O,是由一个氧原子和两个氢原子构成的,因此选A。
(2)粉笔灰加入水中会形成悬浊液,蔗糖加入水中会形成溶液,植物油加入水中会形成乳浊液。故选 C。
(3)硬水是含有较多可溶性的钙、镁化合物的水,因此硬水中含有较多的Ca2+、Mg2+。生活中,检验水是硬水还是软水可用肥皂水,在等量的水样中分别加入等量的肥皂水振荡,泡沫多的是软水,泡沫少的是硬水。
(4)A、水分子在电场作用下,分解成氢原子和氧原子,氢原子与氢原子结合生成氢分子,氧原子和氧原子结合成氧分子,形成氢气和氧气,说明分子可以再分。故A选项正确;
B、普通的水中由于离子的浓度太低,因而导电性低,加了硫酸后,增加了溶液中离子的浓度,导电性增加,B选项正确;
C、电解水实验中,正极产生氧气,负极产生氢气,体积比为1:2,而非质量比,故C选项错误;
D、与正极相连的玻璃管内得到的气体是氧气,氧气能使带火星的木条复燃,故D选项正确。
故本题选ABD。

【题目】我国是世界化肥第一生产大国和消费大国。以空气和煤炭等为化工原料,可合成氨、尿素(CO(NH2)2),主要生产工艺流程如下图所示。回答下列问题:
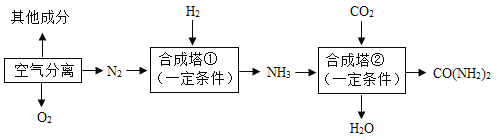
(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。从液态空气中分离出N2的过程属于____(填“物理”或“化学”)变化。空气中含量少量的稀有气体,其化学性质极为_____(填“活泼”或“稳定”)。
(2)氢气通过煤和水蒸气在高温时反应得到的合成气(H2、CO)提取,制备合成气前需先将煤粉碎,这样做的目的是_____,反应的基本类型为________。
(3)写出合成塔①中合成氨的化学方程式为________。尿素属于_____(填“氮”“钾”“磷”或“复合”)肥。
(4)压强为101kPa下,氨气在不同温度下的溶解度如下表。氨水是氨气的水溶液,贮存时氨水要注意_____。
温度/℃ | 10 | 20 | 30 | 60 |
溶解度/g | 70 | 56 | 44.5 | 20 |
(5)2019年全国节能宣传周主题为“绿色发展,节能先行”。其中符合要求的___(填序号)
A 烟囱中排放出未经处理的烟尘、废水和废气
B 综合采用煤的洁净化技术
C 循环利用氮气、氢气和水
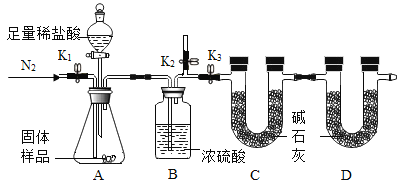
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
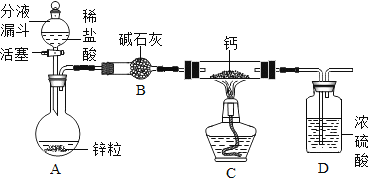
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
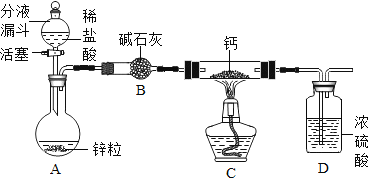
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)