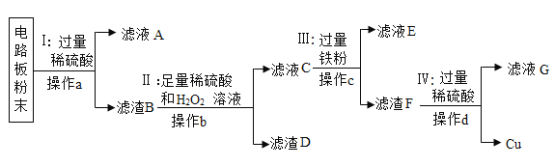
题目内容
【题目】某同学学习CO2的制取和性质时,设计了下列实验探究内容。按要求答题。
(1)不同实验对反应速率有不同要求。从所提供的限选选项中选择合适选项填写下表:
限选控制反应速率的方法:①反应物的浓度 ②反应物的状态 ③催化剂
限选试剂:A稀盐酸 B浓盐酸 C块状石灰石 D碳酸钠溶液 E粉末状石灰石 F二氧化锰G.H2O2溶液
实验名称 | 所选用的最佳试剂 | 控制速率的方法 |
过氧化氢制氧气(示例) | G和F | ③ |
CO2的实验室制法 | A和_______ | ________ |
(2)为探究SO2与CO2的性质异同,设计了如下实验:在水槽中注入一定体积的蒸馏水,并向其中滴加几滴试剂X,然后将分别集满SO2和CO2两种气体的试管同时倒立于水槽中,片刻后实验现象如右图所示,试管内溶液变成红色。请完成下面的实验报告:
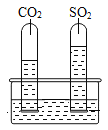
①SO2与CO2一样可溶于水,溶解性SO2_____CO2(填“>”或“<”或“=”)。
②SO2与CO2一样与水反应,均生成了有酸性的物质,X是______。
【答案】C ② > 紫色石蕊试剂
【解析】
(1)由题意可知,实验室制取二氧化碳时采用的时稀盐酸与块状大理石,题目中已给出采用稀盐酸(浓盐酸具有强挥发性,故用稀盐酸),让我们选择用块状石灰石还是粉末状石灰石,由于粉末状石灰石反应速率过快,不好收集,故选用块状大理石,属于控制反应物的状态;
故填:C;②;
(2)①由题意可知,二氧化硫和二氧化碳都可溶于水,但是图中二氧化硫试管中水明显较多,说明二氧化硫试管内气体在水中溶解的较多,反之,二氧化碳溶解在水中的较少,故二氧化硫的溶解性大于二氧化碳的溶解性;
故填:>;
②由题意可知,二氧化硫与二氧化碳溶于水都生成的酸性物质,而X试剂遇酸性物质变成红色,符合紫色石蕊试剂的性质;
故填:紫色石蕊试剂。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我国是世界化肥第一生产大国和消费大国。以空气和煤炭等为化工原料,可合成氨、尿素(CO(NH2)2),主要生产工艺流程如下图所示。回答下列问题:
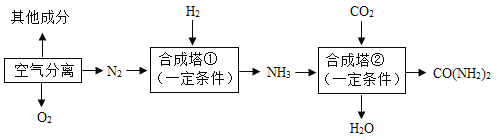
(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。从液态空气中分离出N2的过程属于____(填“物理”或“化学”)变化。空气中含量少量的稀有气体,其化学性质极为_____(填“活泼”或“稳定”)。
(2)氢气通过煤和水蒸气在高温时反应得到的合成气(H2、CO)提取,制备合成气前需先将煤粉碎,这样做的目的是_____,反应的基本类型为________。
(3)写出合成塔①中合成氨的化学方程式为________。尿素属于_____(填“氮”“钾”“磷”或“复合”)肥。
(4)压强为101kPa下,氨气在不同温度下的溶解度如下表。氨水是氨气的水溶液,贮存时氨水要注意_____。
温度/℃ | 10 | 20 | 30 | 60 |
溶解度/g | 70 | 56 | 44.5 | 20 |
(5)2019年全国节能宣传周主题为“绿色发展,节能先行”。其中符合要求的___(填序号)
A 烟囱中排放出未经处理的烟尘、废水和废气
B 综合采用煤的洁净化技术
C 循环利用氮气、氢气和水
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
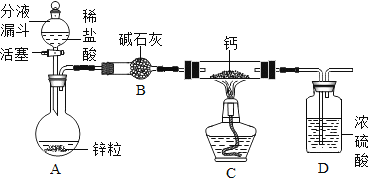
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)
【题目】某化学小组探究炼铁的反应原理。
(一)利用图装置回答问题(假设赤铁矿粉样品中的Fe2O3完全反应,赤铁矿中杂质不参与反应):
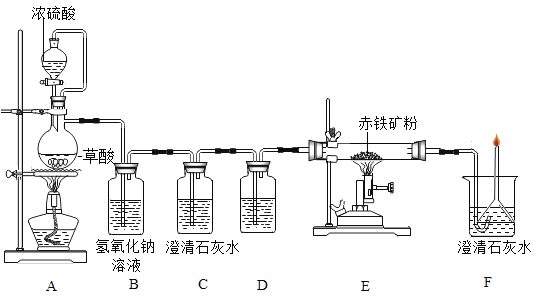
(1)A装置的作用是制取一氧化碳,反应的化学方程式为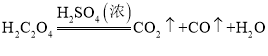 。根据反应装置判断,化学方程式中还缺少的条件是___________________。
。根据反应装置判断,化学方程式中还缺少的条件是___________________。
(2)C装置的作用是______,D装置中药品的名称是________,E装置中发生反应的化学方程式为________,F处将尾气燃烧掉的目的是______。
(3)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为________。
玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
65.6g | 75.6g | 73.2g |
(4)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?
说出你的观点和理由是_______。
(二)利用图装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置和尾气处理装置略,所用固体药品为纯净物)。
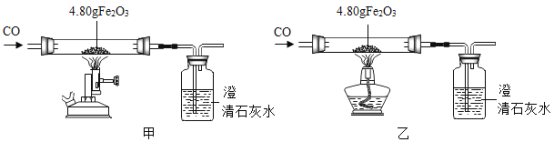
(1)反应过程中观察到,甲、乙两组的澄清石灰水均变浑浊,集气瓶中发生反应的化学方程式为________。
(2)完全反应后,甲、乙两组的生成物均为黑色粉末,分别用两组的生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 称量黑色粉末质量/g | m1 | m2 |
2 | 取黑色粉末,用磁铁吸引 | 全部被吸引 | 全部被吸引 |
3 | 取黑色粉末,加入足量CuSO4溶液 | 黑色粉末溶解,有红色物质生成 | 无明显现象 |
(注:铁的氧化物中,只有Fe3O4能被磁铁吸引)
①甲组的黑色粉末与CuSO4溶液反应的化学方程式是_____。
②小明同学查阅资料后发现Fe3O4在常温下不与CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。
小丽提出不同意见:假设乙组黑色粉末中除了有Fe3O4,还可能含有少量铁粉,铁粉的含量低,与硫酸铜溶液反应也可能无明显现象。
了进一步确定乙组生成物成分,小组同学提出,如果m2恰好为______________g,则小明的猜想正确,如果m2_____________________(填“大于”或“小于”)该质量,则乙组生成物中还含有少量铁粉。