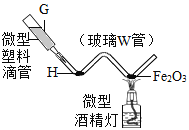
题目内容
【题目】如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
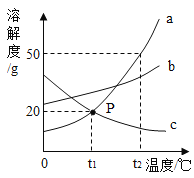
(1)P点的含义是__________________。
(2)在t2℃时,向30克a物质中加入50克水,充分溶解后所得溶液的质量分数是________________。
(3)使t2℃时接近饱和的c溶液变为饱和溶液,可采用的一种方法是______________;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,所得溶液中溶质质量分数大小关系是______________________。
(5)a物质中含有少量c物质,可用__________________方法提纯a物质。
【答案】在t1℃时ac的溶解度相等 33.3% 加入溶质c(或蒸发溶剂) b>a>c 降温结晶
【解析】
(1)P点的含义是在t1℃时ac的溶解度相等;
(2)在t2℃时,a的溶解度是50g,即100g水在此温度下最多能溶解50g,则向30克a物质中加入50克水,可得溶液75g,溶质25g,所得溶液的质量分数是33.3%;
(3)使t2℃时接近饱和的c溶液变为饱和溶液,可采用的方法是加入溶质c或蒸发溶剂;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,ab的溶解度增大,但是溶质的质量分数不变,c的溶解度随温度升高而减小,则所得溶液中溶质质量分数大小关系是b>a>c;
(5)a物质的溶解度随温度的升高而升高,故a物质中若含有少量c物质,可用降温结晶的方法提纯a物质。

 科学实验活动册系列答案
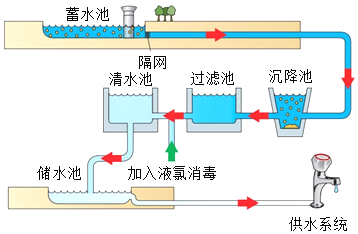
科学实验活动册系列答案【题目】我国是世界化肥第一生产大国和消费大国。以空气和煤炭等为化工原料,可合成氨、尿素(CO(NH2)2),主要生产工艺流程如下图所示。回答下列问题:
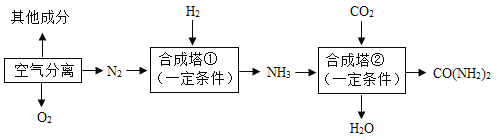
(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。从液态空气中分离出N2的过程属于____(填“物理”或“化学”)变化。空气中含量少量的稀有气体,其化学性质极为_____(填“活泼”或“稳定”)。
(2)氢气通过煤和水蒸气在高温时反应得到的合成气(H2、CO)提取,制备合成气前需先将煤粉碎,这样做的目的是_____,反应的基本类型为________。
(3)写出合成塔①中合成氨的化学方程式为________。尿素属于_____(填“氮”“钾”“磷”或“复合”)肥。
(4)压强为101kPa下,氨气在不同温度下的溶解度如下表。氨水是氨气的水溶液,贮存时氨水要注意_____。
温度/℃ | 10 | 20 | 30 | 60 |
溶解度/g | 70 | 56 | 44.5 | 20 |
(5)2019年全国节能宣传周主题为“绿色发展,节能先行”。其中符合要求的___(填序号)
A 烟囱中排放出未经处理的烟尘、废水和废气
B 综合采用煤的洁净化技术
C 循环利用氮气、氢气和水
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
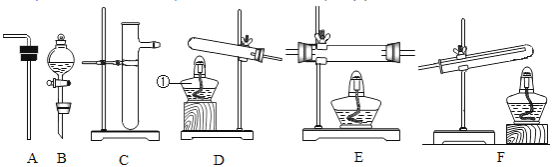
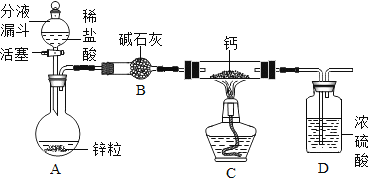
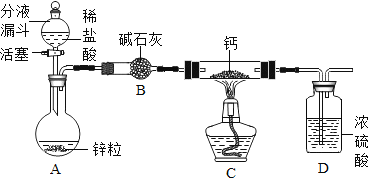
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)