题目内容
【题目】某化学学习小组在学习常见的盐的性质后,完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程,并将答案填入空白相应位置。
(提出问题)上层清液中含有什么溶质?
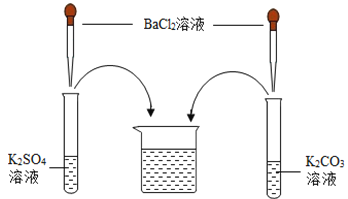
(作出猜想)Ⅰ溶质仅为_____(填化学式);Ⅱ溶质为KCl和BaCl2;Ⅲ溶质为KCl和_____(填化学式);Ⅳ溶质为KCl和K2CO3;Ⅴ溶质为KCl、K2SO4和K2CO3;Ⅵ溶质为KCl、K2SO4、BaCl2和K2CO3。
(交流讨论)小强同学认为猜想Ⅵ一定是错误的,他的理由是_____。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液缸中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加盐酸至过量 | 无明显现象 | 猜想Ⅳ、Ⅴ不正确 |
再向乙试管中滴加_____溶液(填化学式) | _____ | 猜想Ⅱ正确 | |
(交流反思)学习小组经过讨论认为:实验过程中无须使用AgNO3溶液,其理由是_____(用文字表述)。
【答案】KCl K2SO4 BaCl2和K2CO3不能共存 K2SO4或K2CO3 产生白色沉淀 氯化钾、氯化钡、硫酸钾均能与硝酸银溶液反应生成白色沉淀
【解析】
作出猜想:
将氯化钡溶液分别加入硫酸钾和碳酸钾溶液中,![]() ,
,![]() ,结合猜想Ⅰ~Ⅵ,可得出,Ⅰ溶质仅为KCl;Ⅲ溶质为KCl和K2SO4;
,结合猜想Ⅰ~Ⅵ,可得出,Ⅰ溶质仅为KCl;Ⅲ溶质为KCl和K2SO4;
交流讨论:
BaCl2能和K2SO4、K2CO3发生反应生成硫酸钡沉淀和碳酸钡沉淀,不能共存,故猜想Ⅵ一定是错误的;
实验结论为:猜想Ⅱ成立,猜想Ⅱ为:溶质为KCl和BaCl2,故应验证氯化钡的存在,实验操作:向乙试管中加入K2SO4或K2CO3,氯化钡能与硫酸钾或碳酸钾反应生成硫酸钡沉淀和碳酸钡沉淀,实验现象为:有白色沉淀产生;
交流反思:
实验过程中无须使用AgNO3溶液,原因是氯化钾、氯化钡、硫酸钾均能与硝酸银溶液反应生成白色沉淀。

【题目】现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4=CuSO4+H2O)
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
试回答下列问题:
(1)上述表格中m的值为______,10g样品中CuO的质量为______g.
(2)计算所加入稀硫酸中溶质的质量分数?______
(3)计算第三次加稀硫酸反应后所得溶液中溶质的质量分数?(精确到0.1%)_____
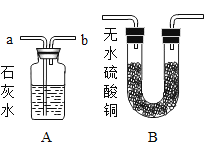
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图所示。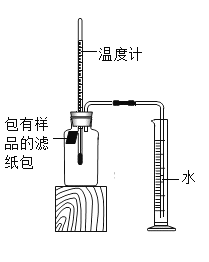
观察到量筒内水沿导管慢慢进入广口瓶(净容积为146ml,当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | 1g铁粉.0.2g碳,10滴水和少量NaCl | 100 | 70 | 约70 |
3 |
(1)实验①和②说明NaCl可以______(填“加快”或“减慢”)铁绣蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_______(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是______。
(4)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。______
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是______%(保留3位有效数字)。