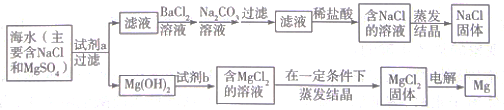
题目内容
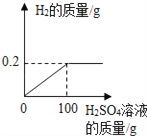
【题目】现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4=CuSO4+H2O)
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
试回答下列问题:
(1)上述表格中m的值为______,10g样品中CuO的质量为______g.
(2)计算所加入稀硫酸中溶质的质量分数?______
(3)计算第三次加稀硫酸反应后所得溶液中溶质的质量分数?(精确到0.1%)_____
【答案】3 7 12.25% 18.2%
【解析】
(1)根据实验数据分析出加入的稀硫酸与参加反应的氧化铜的质量比关系,进而可确定m的值;固体前后减少的质量为氧化铜的质量;
(2)根据实验数据可知20克稀硫酸与2克氧化铜恰好完全反应,利用氧化铜与硫酸反应的化学方程式,根据2克氧化铜的质量求出20克稀硫酸中溶质的质量,最后根据![]() ,求出稀硫酸中溶质的质量分数;
,求出稀硫酸中溶质的质量分数;
(3)第三次反应后60克稀硫酸与6克氧化铜恰好完全反应,所得溶液中溶质的质量分数=![]() ,溶质为硫酸铜,根据6克氧化铜的质量可求出,所得溶液的质量=参加反应的氧化铜的质量+所加稀硫酸的质量。
,溶质为硫酸铜,根据6克氧化铜的质量可求出,所得溶液的质量=参加反应的氧化铜的质量+所加稀硫酸的质量。
(1)根据实验数据分析可知,第一次加入20克稀硫酸,有10g-8g=2g CuO被消耗掉,因此每20克稀硫酸与2克氧化铜恰好完全反应,第四次加入20克稀硫酸后只减小了1克氧化铜,说明氧化铜已反应完,第五次再加入稀硫酸,剩余固体的质量也不会减少,所以m的值为3;氧化铜的质量=10g-3g=7g;
(2)设20克稀硫酸中溶质的质量为x
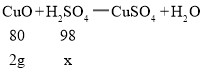
![]()
x=2.45g
H2SO4溶液中溶质质量分数=![]() ×100%=12.25%;
×100%=12.25%;
(3)设第三次加稀硫酸反应后所得溶液中溶质的质量为y,
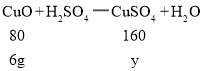
![]()
y=12g
第三次加稀硫酸反应后所得溶液中溶质质量分数=![]() ×100%≈18.2%。
×100%≈18.2%。

 通城学典默写能手系列答案
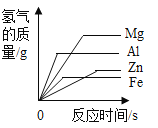
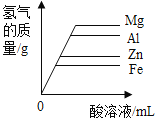
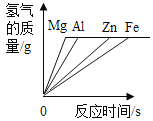
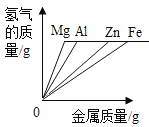
通城学典默写能手系列答案【题目】镁、铝、锌、铁与稀盐酸或稀硫酸之间的反应规律及图象正确的是( )
|
|
|
|
A等质量的镁、铝、锌、铁与足量酸反应,氢气质量与反应时间的关系图象 | B等质量的镁、铝、锌、铁与足量酸反应,氢气质量与酸溶液的关系图象 | C等量酸与足量镁、铝、锌、铁反应,氢气质量与反应时间的关系图象 | D等量酸与足量镁、铝、锌、铁反应,氢气质量与金属质量的关系图象 |
A.AB.BC.CD.D
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1
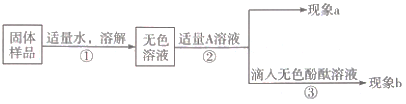
【题目】某化学学习小组在学习常见的盐的性质后,完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程,并将答案填入空白相应位置。
(提出问题)上层清液中含有什么溶质?
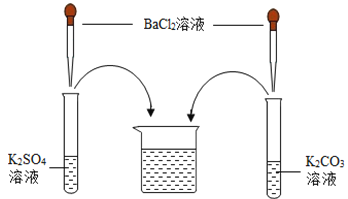
(作出猜想)Ⅰ溶质仅为_____(填化学式);Ⅱ溶质为KCl和BaCl2;Ⅲ溶质为KCl和_____(填化学式);Ⅳ溶质为KCl和K2CO3;Ⅴ溶质为KCl、K2SO4和K2CO3;Ⅵ溶质为KCl、K2SO4、BaCl2和K2CO3。
(交流讨论)小强同学认为猜想Ⅵ一定是错误的,他的理由是_____。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液缸中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加盐酸至过量 | 无明显现象 | 猜想Ⅳ、Ⅴ不正确 |
再向乙试管中滴加_____溶液(填化学式) | _____ | 猜想Ⅱ正确 | |
(交流反思)学习小组经过讨论认为:实验过程中无须使用AgNO3溶液,其理由是_____(用文字表述)。