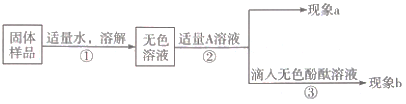
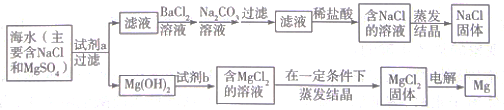
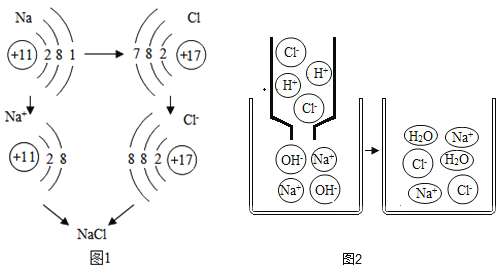
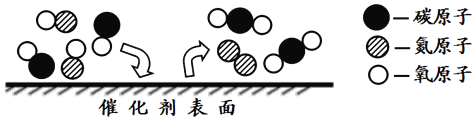
题目内容
【题目】为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。
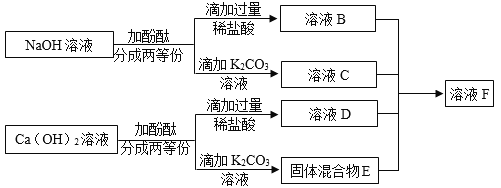
(1)固液混合物中沉淀的化学式是_____。
(2)将溶液B、C、D以及固液混合物E充分混合得到无色溶液F,其中一定含有的溶质是___;可能含有的溶质是____;为了判断可能存在的物质,以下可以选用的是____。
A CuO B Na2CO3 C Cu D pH试纸
【答案】CaCO3 NaCl、CaCl2、KCl HCl ABD
【解析】
(1)氢氧化钙与碳酸钾反应产生碳酸钙沉淀和氢氧化钾溶液,固液混合物中沉淀的化学式是:CaCO3。
(2)氢氧化钠与过量的稀盐酸反应产生氯化钠溶液,则溶液B中一定含有氯化钠和稀盐酸;
氢氧化钠与碳酸钾不反应,则溶液C中一定含有氢氧化钠和碳酸钾;
氢氧化钙与过量的稀盐酸反应产生氯化钙溶液,则D溶液中一定有氯化钙和稀盐酸;
固液混合物E中含有碳酸钙沉淀和氢氧化钾溶液,全部充分混合得到无色溶液F,说明碳酸钙沉淀溶解,盐酸可能过量,盐酸与碳酸钙反应产生氯化钙、水和二氧化碳;同时盐酸与氢氧化钾、碳酸钾反应都产生氯化钾;
其中一定含有的溶质是:氯化钠、氯化钙和氯化钾;盐酸可能过量,则可能含有的溶质是氯化氢;
为了判断盐酸是否存在,以下可以选用的是:
A、.氧化铜与盐酸反应产生氯化铜,溶液先蓝色,当氧化铜加入试剂后,溶液变为蓝色,说明有盐酸,反之则没有;故选项正确;
B、碳酸钠与盐酸反应产生二氧化碳,当碳酸钠加入试剂后,有气泡产生,说明有盐酸,反之则没有;故选项正确;
C、铜与稀盐酸不反应,不能判断是否有盐酸存在;故选项错误;
D、氯化钠和氯化钙溶液均显中性,盐酸显酸性,用pH测量待测液后,若pH<7,说明有盐酸,若pH=7,说明没有盐酸;故选项正确;
故选:ABD。

【题目】某化学学习小组在学习常见的盐的性质后,完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程,并将答案填入空白相应位置。
(提出问题)上层清液中含有什么溶质?
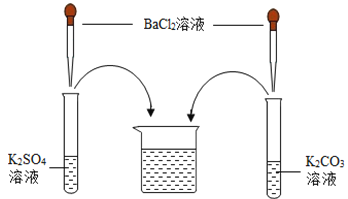
(作出猜想)Ⅰ溶质仅为_____(填化学式);Ⅱ溶质为KCl和BaCl2;Ⅲ溶质为KCl和_____(填化学式);Ⅳ溶质为KCl和K2CO3;Ⅴ溶质为KCl、K2SO4和K2CO3;Ⅵ溶质为KCl、K2SO4、BaCl2和K2CO3。
(交流讨论)小强同学认为猜想Ⅵ一定是错误的,他的理由是_____。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液缸中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加盐酸至过量 | 无明显现象 | 猜想Ⅳ、Ⅴ不正确 |
再向乙试管中滴加_____溶液(填化学式) | _____ | 猜想Ⅱ正确 | |
(交流反思)学习小组经过讨论认为:实验过程中无须使用AgNO3溶液,其理由是_____(用文字表述)。
【题目】为了测定某铜锌合金中铜的质量分数,某同学利用该合金与稀盐酸反应,进行了三次实验,有关实验数据记录如下(实验中的误差忽略不计)。
第一次 | 第二次 | 第三次 | |
所取合金的质量/g | 25 | 25 | 50 |
所用稀盐酸的质量/g | 120 | 160 | 100 |
生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(1)分析表格数据可知,合金与所用稀盐酸的质量比为_____时,合金中的锌与稀盐酸中的HCl 恰好完全反应。
(2)试计算该铜锌合金中铜的质量分数_____。