题目内容
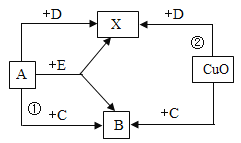
【题目】“碳捕捉技术”是指通过一定 的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。下列有关该方法的叙述中不正确的是( )
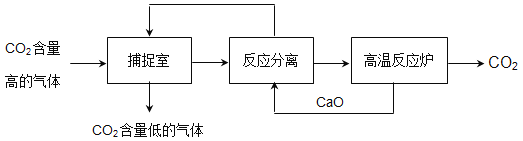
A.因为有高温反应炉,所以反应能耗大
B.“反应分离”中的基本操作是过滤
C.该方法可减少碳排放
D.整个过程中只有一种物质可以循环利用
【答案】D
【解析】
A、因为有高温反应炉,所以反应能耗大,不符合题意;
B、在“反应、分离”中发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,所以分离CaCO3和NaOH用过滤操作,不符合题意;
C、因为二氧化碳是造成温室效应的主要气体之一,该方法减少了二氧化碳的排放,不符合题意;
D、在反应中,氧化钙和氢氧化钠都可以循环利用,符合题意。故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
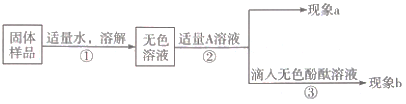
小学生10分钟应用题系列答案【题目】某化学学习小组在学习常见的盐的性质后,完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程,并将答案填入空白相应位置。
(提出问题)上层清液中含有什么溶质?
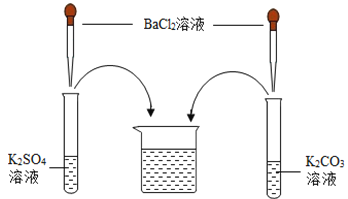
(作出猜想)Ⅰ溶质仅为_____(填化学式);Ⅱ溶质为KCl和BaCl2;Ⅲ溶质为KCl和_____(填化学式);Ⅳ溶质为KCl和K2CO3;Ⅴ溶质为KCl、K2SO4和K2CO3;Ⅵ溶质为KCl、K2SO4、BaCl2和K2CO3。
(交流讨论)小强同学认为猜想Ⅵ一定是错误的,他的理由是_____。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液缸中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加盐酸至过量 | 无明显现象 | 猜想Ⅳ、Ⅴ不正确 |
再向乙试管中滴加_____溶液(填化学式) | _____ | 猜想Ⅱ正确 | |
(交流反思)学习小组经过讨论认为:实验过程中无须使用AgNO3溶液,其理由是_____(用文字表述)。
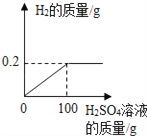
【题目】为了测定某铜锌合金中铜的质量分数,某同学利用该合金与稀盐酸反应,进行了三次实验,有关实验数据记录如下(实验中的误差忽略不计)。
第一次 | 第二次 | 第三次 | |
所取合金的质量/g | 25 | 25 | 50 |
所用稀盐酸的质量/g | 120 | 160 | 100 |
生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(1)分析表格数据可知,合金与所用稀盐酸的质量比为_____时,合金中的锌与稀盐酸中的HCl 恰好完全反应。
(2)试计算该铜锌合金中铜的质量分数_____。