题目内容
【题目】测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
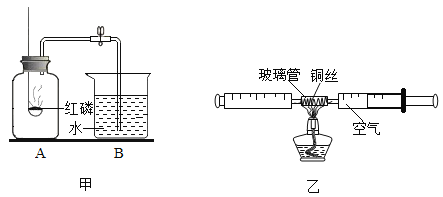
(1)在甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到的现象是_____,写出红磷燃烧的符号表达式_____。
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是_____。
(3)写出乙装置实验中反应的符号表达式_____。
(4)乙装置实验中测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出测定的空气中氧气的体积分数_____2l%(填“>”、“=”或“<”),造成该实验出现误差的原因可能是_____。(填序号)
①没有交替缓缓推动两个注射器活塞; ②读数时没有冷却至室温;
③加入铜丝量太多; ④加入铜丝量太少
(5)乙装置与甲装置相比较,优点在于_____(任答一点)。
【答案】水进入集气瓶,并且约占集气瓶容积的五分之一 P+O2![]() P2O5 使装置中的氧气完全反应 Cu+O2
P2O5 使装置中的氧气完全反应 Cu+O2![]() CuO < ①②④ 结果更准确
CuO < ①②④ 结果更准确
【解析】
(1)磷在氧气中燃烧生在五氧化二磷。反应后容器内的气压降低。当温度降到室温,打开止水夹,会观察到的现象是水进入集气瓶,并且约占集气瓶容积的五分之一;红磷燃烧的符号表达式为:P+O2![]() P2O5;
P2O5;
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是使装置中的氧气完全反应;
(3)铜在空气中加热与氧气反应生成氧化铜。乙装置实验中反应的化学方程式为:Cu+O2![]() CuO;
CuO;
(4)反应前注射器内气体的体积为25mL,反应后注射器内气体的体积为22mL,则氧气的体积为3mL,则空气中氧气的体积分数![]() 。,造成该实验出现误差的原因可能是:没有交替缓缓推动两个注射器活塞;读数时没有冷却至室温;加入铜丝量太少,故选①②④;
。,造成该实验出现误差的原因可能是:没有交替缓缓推动两个注射器活塞;读数时没有冷却至室温;加入铜丝量太少,故选①②④;
(5)乙装置与甲装置相比较,优点在于:结果更准确,操作更简单。