题目内容
【题目】Ⅰ.知物质甲乙丙及CuSO4的溶解度曲线如图所示:
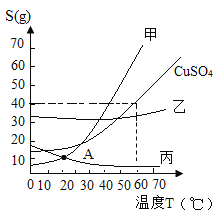
(1)对于处于 A 点的甲丙两物质的溶液,有关说法不正确的是(填编号)___________。
①都是饱和溶液; ②甲丙溶解度相等;
③溶液质量分数相等; ④溶液总质量相等;
⑤升温甲变为不饱和溶液,丙中析出固体
(2)若甲中混有少量的杂质乙,则除去乙的正确方法是(填编号)________。
①蒸发结晶 ②降温结晶 ③溶解过滤
(3)60℃时,CuSO4饱和溶液中溶质的质量百分数为(保留一位小数)__________。
(4)若将 16g 无水CuSO4加入足量CuSO4饱和溶液中,则析出CuSO45H2O 晶体的质量为(填编号)_____________。
①等于 16g ②大于 16 g 小于 25 g ③大于 25 g ④等于 25 g ⑤小于 25 g
Ⅱ.已知Cu2H2SO4 (浓) ![]() CuSO4SO22H2O 若将 36g Cu 和CuO 的混合物完全溶于过量热的浓 H2SO4中,冷却后加入水中稀释后再加入过量铁屑充分反应,放出气体质量为 1g,过滤洗涤干燥称重固体质量比加入的铁屑质量减少 24g,则原混合物中Cu 的质量为________________ g。
CuSO4SO22H2O 若将 36g Cu 和CuO 的混合物完全溶于过量热的浓 H2SO4中,冷却后加入水中稀释后再加入过量铁屑充分反应,放出气体质量为 1g,过滤洗涤干燥称重固体质量比加入的铁屑质量减少 24g,则原混合物中Cu 的质量为________________ g。
【答案】①③④⑤ ② 28.6% ③ 16
【解析】
溶解度的曲线上的每个点代表了在确定温度下,100g水能溶解的最大限度,即溶解度,不能知道溶液的质量,溶质的质量及溶液是否饱和;可以根据溶解度计算饱和溶液的质量分数=![]() ;用结晶的方式可以减少混合物中的少量杂质。
;用结晶的方式可以减少混合物中的少量杂质。
Ⅰ.(1)溶解度曲线上的每个点代表了在确定温度下,100g水能溶解溶质的最大限度,即溶解度,A点是甲与丙的交点,溶解度是相等的,但不能知道溶液的质量,溶质的质量,及溶液是否饱和,丙溶液不确定是饱和溶液,升温时也不一定有固体析出,故说法不正确是①③④⑤;
(2)甲的溶解度随着温度的变化而变化的幅度大,而乙变化的幅度小,当甲与乙的混合溶液接近饱和时,溶剂不变,只降低温度,那么甲会析出大量晶体,乙不析出晶体或析出很少的晶体,因此过滤得到甲的晶体,乙留在母液中,故选②;
(3)60℃时,CuSO4饱和溶液中溶质的质量百分数=![]() ≈28.6%;
≈28.6%;
(4)无水CuSO4固体加入溶液中会吸收水分,形成CuSO45H2O 晶体,又因为是CuSO4的饱和溶液,故新加入的CuSO45H2O 晶体不会溶解,根据CuSO4固体的质量计算可知CuSO45H2O 晶体的质量=![]() =25g,因为溶液中的溶剂减少了,溶液会再析出CuSO45H2O 晶体,则析出的CuSO45H2O 晶体质量要大于25g,故选③;
=25g,因为溶液中的溶剂减少了,溶液会再析出CuSO45H2O 晶体,则析出的CuSO45H2O 晶体质量要大于25g,故选③;
Ⅱ. 将 36g Cu 和CuO 的混合物完全溶于过量热的浓 H2SO4中,所以的铜元素都生成了![]() ,加水稀释后,溶液中有
,加水稀释后,溶液中有![]() 和稀
和稀![]() ,加入过量的铁屑,铁先与稀
,加入过量的铁屑,铁先与稀![]() 反应生成氢气1g,设消耗铁的质量为x
反应生成氢气1g,设消耗铁的质量为x
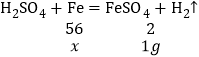
![]() ,x=28g,过量的铁再与
,x=28g,过量的铁再与![]() 反应,过滤洗涤干燥称重固体质量比加入的铁屑质量减少 24g,故铁再与
反应,过滤洗涤干燥称重固体质量比加入的铁屑质量减少 24g,故铁再与![]() 反应增加了28g-24g=4g,设反应生成
反应增加了28g-24g=4g,设反应生成![]() 的质量为y,
的质量为y,
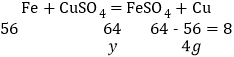
![]() ,y=32g,故铜元素的质量为32g,根据质量守恒定律可知,可知反应前与反应后铜元素的质量不变,混合物中氧元素的质量为36g-32g=4g,求
,y=32g,故铜元素的质量为32g,根据质量守恒定律可知,可知反应前与反应后铜元素的质量不变,混合物中氧元素的质量为36g-32g=4g,求![]() 的质量=
的质量=![]() =20g,故混合物中
=20g,故混合物中![]() 的质量=36g-20g=16g。
的质量=36g-20g=16g。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
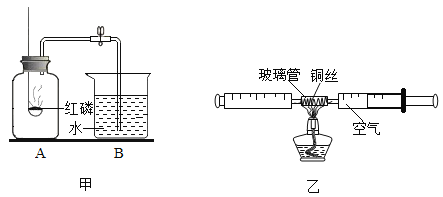
(1)在甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到的现象是_____,写出红磷燃烧的符号表达式_____。
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是_____。
(3)写出乙装置实验中反应的符号表达式_____。
(4)乙装置实验中测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出测定的空气中氧气的体积分数_____2l%(填“>”、“=”或“<”),造成该实验出现误差的原因可能是_____。(填序号)
①没有交替缓缓推动两个注射器活塞; ②读数时没有冷却至室温;
③加入铜丝量太多; ④加入铜丝量太少
(5)乙装置与甲装置相比较,优点在于_____(任答一点)。