题目内容
【题目】向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是( )
A. 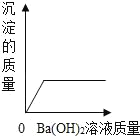 B.
B. 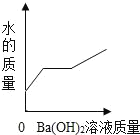
C. 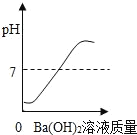 D.
D. 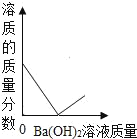
【答案】B
【解析】
A.稀硫酸和氢氧化钡能反应生成硫酸钡沉淀和水,当硫酸反应完后,沉淀的质量不再改变,故A正确;
B.不断慢慢滴加10%的Ba(OH)2溶液至过量,水的质量不断增加,不会出现不变的情况,故B错误;
C.硫酸的pH小于7,当硫酸与氢氧化钡完全反应时溶液的pH等于7,加入氢氧化钡过量时,溶液的pH大于7,故C正确;
D.稀硫酸和氢氧化钡能反应生成硫酸钡沉淀和水,当两者不断反应时,溶质的质量分数都逐渐减小,当氢氧化钡过量时溶质的质量分数又会逐渐增大,故D正确;
故选:B。

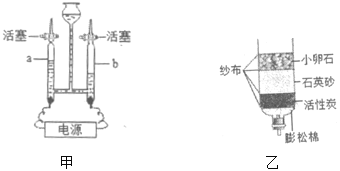
【题目】测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
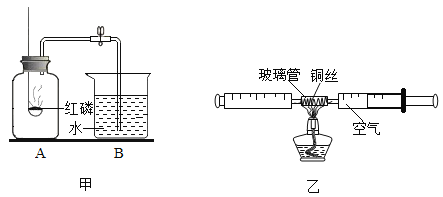
(1)在甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到的现象是_____,写出红磷燃烧的符号表达式_____。
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是_____。
(3)写出乙装置实验中反应的符号表达式_____。
(4)乙装置实验中测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出测定的空气中氧气的体积分数_____2l%(填“>”、“=”或“<”),造成该实验出现误差的原因可能是_____。(填序号)
①没有交替缓缓推动两个注射器活塞; ②读数时没有冷却至室温;
③加入铜丝量太多; ④加入铜丝量太少
(5)乙装置与甲装置相比较,优点在于_____(任答一点)。
【题目】某干果包装中常使用一种袋装的固体防腐剂,其成分为铁粉、生石灰等。甲同学对这种固体久置后的成分十分好奇,于是设计实验并进行探究。
(提出问题)固体久置后的成分是什么?
(猜想与假设)固体中久置后可能有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(进行实验)甲同学的实验记录如下:
实验 | 实验操作 | 实验现象 | 实验结论 |
1 | 研碎固体,并用磁铁充分吸引,得到未被磁铁吸引的残留固体A。 | 磁铁表面有黑色粉末吸附 | ______ |
2 | 向固体A中加足量水,充分溶解。静置过滤,得到滤液B和滤渣C,向滤液B中滴加试剂______ | 部分固体溶解,温度有明显的升高,溶液变为红色 | 固体中有
|
3 | 取滤渣C少量放入试管中,加入足量稀盐酸,并用带导管的单孔塞塞紧试管口,导管另一端伸入澄清石灰水中。 | ______ | 固体中有
|
(解释与结论)
实验3中,导管口有气泡产生的化学方程式为_________。
(反思与评价)
乙同学认为甲同学方案中仍有一种物质不能确定,其理由为_________。