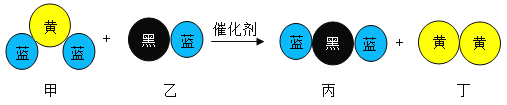
题目内容
【题目】用化学符号表示:
(1)两个氦原子_____;
(2)三个亚铁离子_____;
(3)氧化镁中镁元素显+2价_____;
(4)空气中含量最多的物质_____;
(5)保持氨气化学性质的最小粒子_____。
【答案】2He 3Fe2+ ![]() N2 NH3
N2 NH3
【解析】
(1)根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,因此2个氦原子表示为:2He;
(2)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。表示多个该离子,在其离子符号前加上相应的数字,故三个亚铁离子可表示为:3Fe2+;
(3)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化镁中镁元素显+2价,故可表示为:![]() ;
;
(4)空气中含量最多的物质是氮气,氮气的化学式是N2。
(5)保持氨气化学性质的最小粒子是氨气分子,其化学式为:NH3。

【题目】化学反应有的放出热量称为放热反应,有的吸收热量称为吸热反应。化学反应有快有慢,一般增大反应物浓度、接触面积、升高温度、使用催化剂均可加快反应速率
(1)下列过程是化学变化且是放热反应的是(填编号)_____
A 浓硫酸溶于水
B 生石灰加入水中
C NH4NO3 晶体溶于水
D 天然气燃烧
E 制水煤气
(2)实验室用锌粒与 10mL30%的稀 H2SO4反应制取 H2。
①下列措施不能加快反应速率的是(填编号)_______________________。
A 加热
B 将锌粒换成锌粉
C 将 30%的 H2SO4 换成 50%的 H2SO4
D 将 30%的 H2SO4,增加到 20mL
E加入适量 Na2SO4 固体
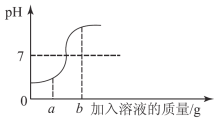
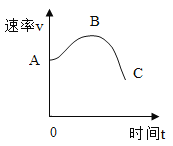
②反应速率v 随时间变化如图所示A→B 速率加快的原因是__________________________;B→C 速率减慢的原因是__________。
(3)实验室用 H2O2 制 O2,为加快反应速率常采取的措施是__________,反应方程式为_____。
(4)已知反应 Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,将一定量 Na2S2O3 溶液、稀 H2SO4 和H2O 同时混合,下列各组实验中最先出现浑浊的是(填编号)______________________。
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O |
A | 20 | 40% 20g | 40% 20g | 10g |
B | 20 | 40% 25g | 40% 20g | 5g |
C | 40 | 80% 10g | 40% 20g | 20g |
D | 40 | 50% 10g | 60% 10g | 5g |
【题目】测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
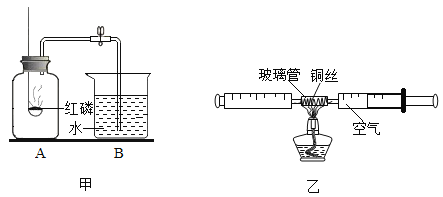
(1)在甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到的现象是_____,写出红磷燃烧的符号表达式_____。
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是_____。
(3)写出乙装置实验中反应的符号表达式_____。
(4)乙装置实验中测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出测定的空气中氧气的体积分数_____2l%(填“>”、“=”或“<”),造成该实验出现误差的原因可能是_____。(填序号)
①没有交替缓缓推动两个注射器活塞; ②读数时没有冷却至室温;
③加入铜丝量太多; ④加入铜丝量太少
(5)乙装置与甲装置相比较,优点在于_____(任答一点)。