题目内容
【题目】某化学兴趣小组提出可以用废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得硫酸锌晶体(ZnSO4·x H2O)。
Ⅰ、硫酸锌晶体的制备
该兴趣小组同学设计了如下流程:

已知:①硫酸锌晶体难溶于酒精
②硫酸锌晶体受热易逐步失去结晶水
③几种物质沉淀时的pH如下表:
物质 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 3.2 | 8.0 | 6.4 |
(1)酸浸中生成硫酸锌的化学方程式为___________,属于________(填基本类型)反应。
(2)酸浸时温度和时间对锌浸出率的影响见下图。为了提高锌的浸出率,反应的最佳温度是__________℃,最佳时间是____________min;

(3)加H2O2的目的是将酸浸后的Fe2+氧化成Fe3+,其反应方程式为2FeSO4 + H2O2 + _____= Fe2(SO4)3 + 2H2O,KMnO4溶液也能将Fe2+氧化成Fe3+,并生成可溶性的锰盐,选择H2O2的优点是_________;
(4)加入ZnO调节溶液的pH约为4的目的是__________;
(5)流程中,滤渣Y的成分为_________________;
(6)流程中“一系列操作”主要过程为:①_________________ 、冷却结晶、过滤,加入酒精洗涤,重复几次,最后低温烘干,得到ZnSO4·xH2O;
②用酒精洗涤的目的是洗去晶体表面的杂质、避免因水洗涤所造成的晶体损耗、_________;
③低温烘干的原因是_______________。
Ⅱ、硫酸锌晶体(ZnSO4·xH2O)组成的测定
学习小组取5.74g硫酸锌晶体(ZnSO4·xH2O)进行加热分解,获得相关数据,并绘制成剩余固体质量一温度的关系图。

(7)280℃时,固体完全失去结晶水。根据图中数据,计算ZnSO4·xH2O中x的值为_____________;(请写出计算过程)
(8)加热过程中,硫酸锌晶体分步失去结晶水。请写出60℃到80℃时反应方程式_________。
【答案】![]() 复分解 90℃ 240
复分解 90℃ 240 ![]() 不引入新的杂质 控制反应只生成氢氧化铁而不生成其他沉淀 过量的Zn和生成的Cu 蒸发浓缩或者加热浓缩 酒精易挥发,便于快速晾干 防止晶体脱水 7
不引入新的杂质 控制反应只生成氢氧化铁而不生成其他沉淀 过量的Zn和生成的Cu 蒸发浓缩或者加热浓缩 酒精易挥发,便于快速晾干 防止晶体脱水 7 
【解析】
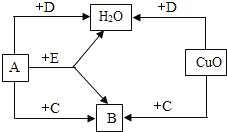
氧化锌和硫酸反应生成硫酸锌和水,硫酸锌晶体受热易逐步失去结晶水。
(1)废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO),酸浸中生成硫酸锌只能是氧化锌和硫酸反应生成硫酸锌和水,对应的化学方程式为![]() ,是两种化合物相互交换成分生成两种新的化合物,属于 复分解反应。
,是两种化合物相互交换成分生成两种新的化合物,属于 复分解反应。
(2))酸浸时温度和时间对锌浸出率的影响见图2.为了提高锌的浸出率,根据图可以看出反应的最佳温度是 90℃,最佳时间是 240min。
(3)根据质量守恒定律,原子个数反应前后不变,故化学式为1个硫原子和4个氧原子,2个氢原子,化学式为![]() ,
,![]() 溶液也能将Fe2+氧化成Fe3+,并生成可溶性的锰盐,选择H2O2的优点是不引入新的杂质。
溶液也能将Fe2+氧化成Fe3+,并生成可溶性的锰盐,选择H2O2的优点是不引入新的杂质。
(4)根据物质沉淀时的pH表,可知加入ZnO调节溶液的pH约为4的目的是控制反应只生成氢氧化铁而不生成其他沉淀。
(5)过程中加入过量X,之后得到的是硫酸锌,所以X为锌,目的是除去铜,滤渣Y的成分为 过量的Zn和生成的Cu。
(6)流程中“一系列操作”主要过程为:①蒸发浓缩或者加热浓缩、冷却结晶、过滤,加入酒精洗涤,重复几次,最后低温烘干,得到ZnSO4xH2O。
②用酒精洗涤的目的是洗去晶体表面的杂质、避免因水洗涤所造成的晶体损耗、酒精易挥发,便于快速晾干。
③根据给出的信息:硫酸锌晶体受热易逐步失去结晶水,所以低温烘干的原因是 防止晶体脱水。
(7)280℃时,固体完全失去结晶水。根据图中数据,即5.74g晶体加热至完全失去结晶水后质量为3.22g。ZnSO4xH2O中硫酸和水的分子个数比为
![]() ,即x的值为 7。
,即x的值为 7。
(8)加热过程中,硫酸锌晶体分步失去结晶水。60℃是对应的是硫酸和水的分子个数比为
![]() ,即此时物质为ZnSO46H2O,到80℃时硫酸和水的分子个数比为
,即此时物质为ZnSO46H2O,到80℃时硫酸和水的分子个数比为![]() ,所以对应物质为ZnSO4H2O,所以对应的反应方程式为
,所以对应物质为ZnSO4H2O,所以对应的反应方程式为 。
。