题目内容
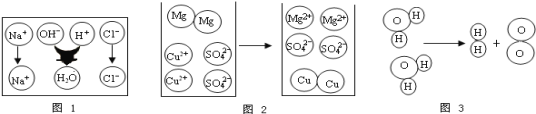
【题目】如图中A、B、C、D、E五种物质是初中化学常见的金属单质、非金属氧化物、酸、碱、盐中的一种,相邻物质能发生化学反应。A与B之间可发生置换反应,B的水溶液呈蓝色。请回答:
(1)A的化学式________(写一个)。
(2)B与C反应的化学方程式可能是__________。
(3)E的用途是____________。
(4)D还能与图中不相邻的一种物质反应,该反应的化学方程式可能是_________。
【答案】Fe(或Al) CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4(合理即可) 冶炼金属 Fe+2HCl ===FeCl2+H2↑(或2Al+6HCl === 2AlCl3+3H2↑,与(1)中空对应,合理即可)
【解析】
A与B之间可发生置换反应,B的水溶液呈蓝色,故是铜盐溶液与活泼的金属反应生成铜,A能与氧气反应,故A可能是铁(或铝),B可能是硫酸铜,E既能与氧气反应,也能与氧化铁反应,故E可能是一氧化碳;氧化铁能与D反应,故D可能是盐酸,C既能与硫酸铜反应又能与盐酸反应,故C可能是氢氧化钠,带入框图,推断合理;
(1)A可以是铁(或铝),化学式为Fe(或Al);
(2)B是硫酸铜,C是氢氧化钠,硫酸铜能与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,化学反应方程式:CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4;
(3)E是一氧化碳,能用于冶炼金属;
(4)D是盐酸,能与不相邻的铁(或铝)反应生成氯化亚铁(或氯化铝)和氢气,化学方程式为Fe+2HCl ===FeCl2+H2↑(或2Al+6HCl === 2AlCl3+3H2↑与(1)中空对应,合理即可)。

 阅读快车系列答案
阅读快车系列答案【题目】下列反应中,属于置换反应的是
A. 2Al2O3![]() 4Al+3O2↑ B. C2H5OH+302
4Al+3O2↑ B. C2H5OH+302![]() 2CO2+3H20
2CO2+3H20
C. 2Mg+CO2![]() 2MgO+C D. AgNO3+NaCl=NaNO3+AgCl↓
2MgO+C D. AgNO3+NaCl=NaNO3+AgCl↓
【题目】(1)铁是最重要的金属。
① “百炼成钢”与“铁杵磨针”蕴含的变化原理______(填“相同”或“不相同”)。
② 用图装置完成以下三个实验,每隔一段时间测量U形导管液面高度差,数据如下表。
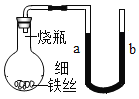
实验序号 | 瓶中盛放的物质 | 0小时 | 1小时 | 2小时 | 3小时 |
① | 干燥的铁丝 | 0cm | 0cm | 0cm | 0cm |
② | 沾食盐水的铁丝 | 0cm | 1.2cm | 5.6cm | 9.8cm |
③ | 沾了清水的铁丝 | 0cm | 0cm | 0.8cm | 3.5cm |
上述实验中,铁生锈的速率由大到小的排列顺序为(填实验序号):______。根据上述实验得出:氧气、_____、______是影响铁生锈快慢的因素。
(2)材料是时代发展的标志。
① 我国用铝合金和石墨烯混合制成的“烯合金”,有望生产出“纸一样薄的手机”。下列关于“烯合金”的说法一定错误的是______(填序号)。
A 具有可燃性 B 具有导电性 C 是一种纯净物
② 我国用铼合金制造飞机发动机叶片的技术取得重大突破,铼的原子结构示意图如图,图中X=_____。
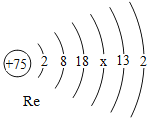
冶炼铼的化学方程式为2KReO4+7H2 ![]() 2Re+6M+2KOH,M的化学式是______。
2Re+6M+2KOH,M的化学式是______。
【题目】(6分)某校同学开展了如下“溶液酸碱性的检验”的实验活动:

(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称 ;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是 ;
(2)用PH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”“中性”或“碱性”)溶液,白醋pH (填“>””<”或”=”)7;
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”“B”或“C”,下同),可能导致北侧溶液pH数值发生改变的错误操作是 。
【题目】某化学兴趣小组提出可以用废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得硫酸锌晶体(ZnSO4·x H2O)。
Ⅰ、硫酸锌晶体的制备
该兴趣小组同学设计了如下流程:

已知:①硫酸锌晶体难溶于酒精
②硫酸锌晶体受热易逐步失去结晶水
③几种物质沉淀时的pH如下表:
物质 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 3.2 | 8.0 | 6.4 |
(1)酸浸中生成硫酸锌的化学方程式为___________,属于________(填基本类型)反应。
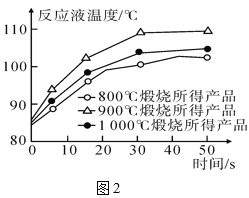
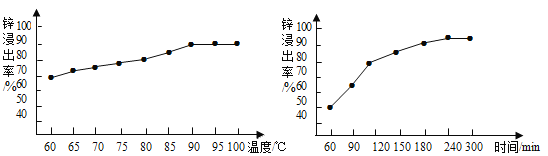
(2)酸浸时温度和时间对锌浸出率的影响见下图。为了提高锌的浸出率,反应的最佳温度是__________℃,最佳时间是____________min;
(3)加H2O2的目的是将酸浸后的Fe2+氧化成Fe3+,其反应方程式为2FeSO4 + H2O2 + _____= Fe2(SO4)3 + 2H2O,KMnO4溶液也能将Fe2+氧化成Fe3+,并生成可溶性的锰盐,选择H2O2的优点是_________;
(4)加入ZnO调节溶液的pH约为4的目的是__________;
(5)流程中,滤渣Y的成分为_________________;
(6)流程中“一系列操作”主要过程为:①_________________ 、冷却结晶、过滤,加入酒精洗涤,重复几次,最后低温烘干,得到ZnSO4·xH2O;
②用酒精洗涤的目的是洗去晶体表面的杂质、避免因水洗涤所造成的晶体损耗、_________;
③低温烘干的原因是_______________。
Ⅱ、硫酸锌晶体(ZnSO4·xH2O)组成的测定
学习小组取5.74g硫酸锌晶体(ZnSO4·xH2O)进行加热分解,获得相关数据,并绘制成剩余固体质量一温度的关系图。
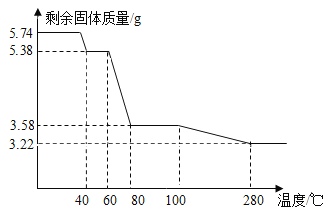
(7)280℃时,固体完全失去结晶水。根据图中数据,计算ZnSO4·xH2O中x的值为_____________;(请写出计算过程)
(8)加热过程中,硫酸锌晶体分步失去结晶水。请写出60℃到80℃时反应方程式_________。