题目内容
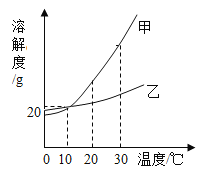
【题目】如图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中正确的是()
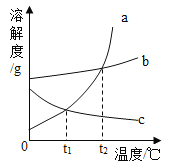
A.当a中含有少量b时,可以用蒸发结晶的方法提纯a
B.t2℃时ab两饱和溶液从t2℃降到t1℃时,析出晶体最多的是a
C.t1℃C时ac两饱和溶液中溶质的质量分数相等
D.t1℃时ac两饱和溶液同时升高到t2℃时两溶液溶质的质量分数不变
【答案】C
【解析】
A、a物质的溶解度受温度变化影响较大,所以当a中含有少量b是,可以用降温结晶的方法提纯a,故A错误;
B、t2℃时a、b两饱和溶液从t2℃降到t1℃时,饱和溶液的质量不能确定,所以析出晶体的多少也不能确定,故B错误;
C、t1℃时,a、c两物质的溶解度相等,所以饱和溶液中溶质的质量分数相等,故C正确;
D、t1℃时,a、c两饱和溶液同时升高到t2℃时,a物质的溶解度最大,c物质的溶解度减小,所以a物质溶质的质量分数不变,c物质的溶质质量分数减小,故D错误。
故选:C。

【题目】(1)铁是最重要的金属。
① “百炼成钢”与“铁杵磨针”蕴含的变化原理______(填“相同”或“不相同”)。
② 用图装置完成以下三个实验,每隔一段时间测量U形导管液面高度差,数据如下表。
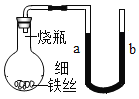
实验序号 | 瓶中盛放的物质 | 0小时 | 1小时 | 2小时 | 3小时 |
① | 干燥的铁丝 | 0cm | 0cm | 0cm | 0cm |
② | 沾食盐水的铁丝 | 0cm | 1.2cm | 5.6cm | 9.8cm |
③ | 沾了清水的铁丝 | 0cm | 0cm | 0.8cm | 3.5cm |
上述实验中,铁生锈的速率由大到小的排列顺序为(填实验序号):______。根据上述实验得出:氧气、_____、______是影响铁生锈快慢的因素。
(2)材料是时代发展的标志。
① 我国用铝合金和石墨烯混合制成的“烯合金”,有望生产出“纸一样薄的手机”。下列关于“烯合金”的说法一定错误的是______(填序号)。
A 具有可燃性 B 具有导电性 C 是一种纯净物
② 我国用铼合金制造飞机发动机叶片的技术取得重大突破,铼的原子结构示意图如图,图中X=_____。
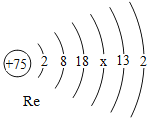
冶炼铼的化学方程式为2KReO4+7H2 ![]() 2Re+6M+2KOH,M的化学式是______。
2Re+6M+2KOH,M的化学式是______。
【题目】某化学兴趣小组提出可以用废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得硫酸锌晶体(ZnSO4·x H2O)。
Ⅰ、硫酸锌晶体的制备
该兴趣小组同学设计了如下流程:

已知:①硫酸锌晶体难溶于酒精
②硫酸锌晶体受热易逐步失去结晶水
③几种物质沉淀时的pH如下表:
物质 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 3.2 | 8.0 | 6.4 |
(1)酸浸中生成硫酸锌的化学方程式为___________,属于________(填基本类型)反应。
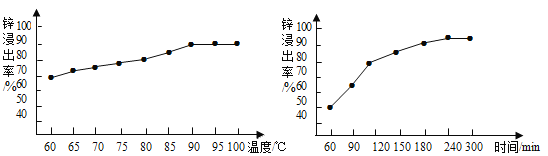
(2)酸浸时温度和时间对锌浸出率的影响见下图。为了提高锌的浸出率,反应的最佳温度是__________℃,最佳时间是____________min;
(3)加H2O2的目的是将酸浸后的Fe2+氧化成Fe3+,其反应方程式为2FeSO4 + H2O2 + _____= Fe2(SO4)3 + 2H2O,KMnO4溶液也能将Fe2+氧化成Fe3+,并生成可溶性的锰盐,选择H2O2的优点是_________;
(4)加入ZnO调节溶液的pH约为4的目的是__________;
(5)流程中,滤渣Y的成分为_________________;
(6)流程中“一系列操作”主要过程为:①_________________ 、冷却结晶、过滤,加入酒精洗涤,重复几次,最后低温烘干,得到ZnSO4·xH2O;
②用酒精洗涤的目的是洗去晶体表面的杂质、避免因水洗涤所造成的晶体损耗、_________;
③低温烘干的原因是_______________。
Ⅱ、硫酸锌晶体(ZnSO4·xH2O)组成的测定
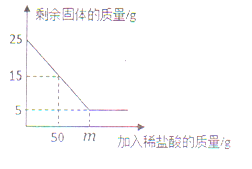
学习小组取5.74g硫酸锌晶体(ZnSO4·xH2O)进行加热分解,获得相关数据,并绘制成剩余固体质量一温度的关系图。
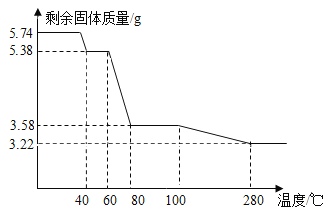
(7)280℃时,固体完全失去结晶水。根据图中数据,计算ZnSO4·xH2O中x的值为_____________;(请写出计算过程)
(8)加热过程中,硫酸锌晶体分步失去结晶水。请写出60℃到80℃时反应方程式_________。
【题目】化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
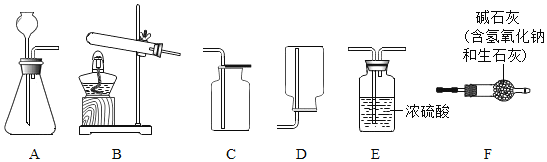
I.气体制备
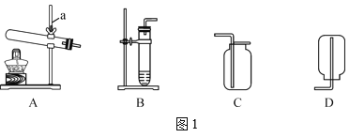
(1)二氧化碳气体制备实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为____________________________.应选择的气体收集装置为____________________________(选填装置对应的字母).实验室不用稀硫酸与石灰石制取二氧化碳的原因是__________________________________________。
(2)氨气制备
实验室常用氢氧化钙固体与氯化铵固体加热制备NH3反应方程式:______________________________________________;现要制备并收集干燥的NH3,所选装置的正确连接顺序为 B→______________________ →_______________________ (选择装置对应的字母).实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式_____________________________________________________.
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因 ______________________________.
(4)该过程中另一产物NH4Cl在农业生产中常被用作_______________.