题目内容
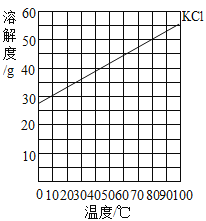
【题目】在下表对应的温度下,向4只盛有100g水的烧杯中,分别加入40 g KCl固体,充分溶解。KCl的溶解度曲线如下图
烧杯序号 | ① | ② | ③ | ④ | ⑤ |
温度(℃) | 20 | 30 | 40 | 50 | 60 |
下列关于①~⑤所得溶液的说法不正确的是()
A.溶质质量①<②
B.⑤溶液通过升温会变饱和溶液
C.溶质质量分数③=④=⑤
D.④中溶质与溶剂的质量比为 2:5
【答案】B
【解析】
根据题意,20℃、30℃、40℃、50℃、60℃时氯化钾的溶解度分别是34g、37g、40g、43g、45g,进行分析判断。
A、20℃、30℃时氯化钾的溶解度分别是34g、37g,向4只盛有100g水的烧杯中,分别加入40 g KCl固体,烧杯①中只能溶解34g,烧杯②中只能溶解37g,烧杯①和②中溶质质量①<②,故正确;
B、氯化钾的溶解度随温度的升高而增大,⑤溶液通过升温会变成不饱和溶液,故错误;
C、40℃、50℃、60℃时氯化钾的溶解度分别是40g、43g、45g,③④⑤烧杯中溶解的氯化钾的质量都为40g,溶剂的质量都为100g,所以溶质质量分数③=④=⑤,故正确;
D、50℃时氯化钾的溶解度是43g,④烧杯中溶质质量是40g,溶剂质量是100g,溶质与溶剂的质量比=40g:100g=2:5,故正确。
故选:B。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
(实验探究1)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体于试管中,溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含_____和氢氧化钙 |
(2)另取少量固体于试管中,滴加足量的_____ | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有______,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | _______ | 固体中一定含有CaCO3 |
(实验质疑)
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_________。
(2)丙同学认为甲同学的实验并不能得出一定不含FeO3的结论,理由是_________。
(实验探究2)乙、丙同学设计如下实验方案继续验证:
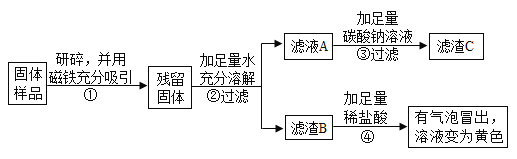
(1)乙、丙同学实验中又能得出固体样品中一定还含有_______,仍有一种物质不能确定,该物质是_______。
(2)乙、丙同学又经过实验测得上述3.9g残留固体中含钙物质的总质量为2.3g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为2.0g。
(实验结论)综合上述实验及所给数据:
(1)判断久置固体的成分是_______。
(2)计算上述残留固体中氧化钙的质量的质量为______克。
【题目】铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______。
(2)铜在工业上可用于生产电缆(外面包裹了电缆皮),这是利用了铜的_____性。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
![]()
(1)含铜废料粉碎的目的是__________。
(2)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为_____。
(3)兴趣小组同学一致指出,将滤液经蒸发浓缩、_____(填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是____________。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
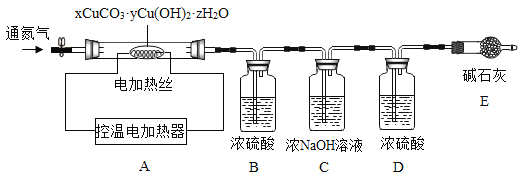
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.4 | 100.2 | 120.5 |
实验分析和数据处理
(1)实验前应该先_________,再鼓入一段时间氮气后称量B、C、D、E的质量。
(2)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______时表明碱式碳酸铜已经完全分解。
(3)反应结束后,再缓缓鼓入一段时间氮气的目的是___________。
(4)该碱式碳酸铜的化学式是__________。
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
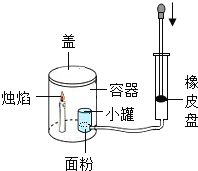
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
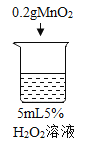
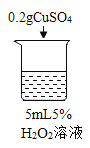
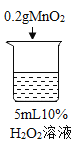
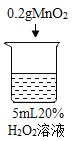
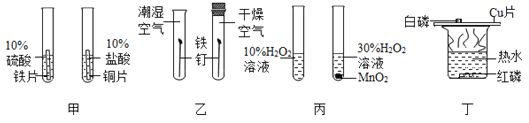
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
【题目】小兵和小东是某校化学研究性学习小组的成员,他们在查阅资料时,发现单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决有关问题。
(提出问题)木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
(猜想与假设)猜想一:可能是CO;猜想二:可能是CO2。
(设计实验方案)
(1)检验CO2的方法是__________(用化学方程式表示)。
(2)为了检验CO,他们设计的方案是:把小动物放在收集的气体中,观察能否存活。后经充分研究,认为此方案不能说明问题,其理由是____________
(查阅资料)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(实验与结论)设计的实验装置图如下图所示,请完成下边的表格。
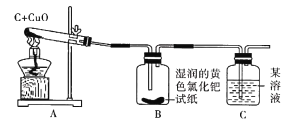
实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有金属铜生成 |
B中黄色试纸没有变蓝 | 没有______生成 |
C中_________ | 有CO2生成 |
(反思与评价)如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是_____。
(注意:若答对第(3)小题奖励2分,化学试卷总分不超过40分。)
(3)对下列三种氧化铜和碳的质量比例,你建议选择_______(填序号)的比例。
A 38:3 B 40:3 C 42:3
你这样选择的理由是__________