题目内容
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
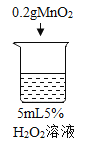
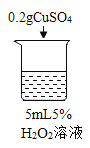
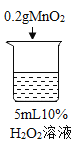
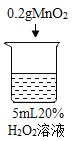
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
【答案】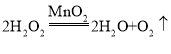 观察5mL、5%的过氧化氢溶液自然分解的速率 1、3、4 过氧化氢分解放热,使烧杯中的水蒸发速率加快 生成的氧气逸散的速率过快,导致烧杯内氧气的浓度过低,带火星的木条无法持续燃烧 AD
观察5mL、5%的过氧化氢溶液自然分解的速率 1、3、4 过氧化氢分解放热,使烧杯中的水蒸发速率加快 生成的氧气逸散的速率过快,导致烧杯内氧气的浓度过低,带火星的木条无法持续燃烧 AD
【解析】
(1)烧杯1中是过氧化氢在二氧化锰的催化作用下生成水和氧气。方程式为: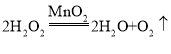 。故答案为:
。故答案为: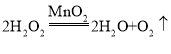 ;
;
(2)为证明二氧化锰和硫酸铜能加快过氧化氢的分解速率,应该增加的对比试验是观察5mL、5%的过氧化氢溶液自然分解的速率,据此作为对比试验。故答案为:观察5mL、5%的过氧化氢溶液自然分解的速率;
(3)证明过氧化氢溶液浓度影响其分解速率,因此只能有过氧化氢浓度这一个变量。因此应该选择实验1、实验3、实验4进行对比。故答案为:1、3、4;
(4)烧杯内出现大量的白雾是因为过氧化氢分解放出热量,使烧杯中的水蒸发速率加快。故答案为:过氧化氢分解放热,使烧杯中的水蒸发速率加快;
(5)烧杯4中木条熄灭的原因可能是氧气逸散的速率过快,从而导致烧杯中的氧气浓度过低,无法使带火星的木条持续燃烧。故答案为:生成的氧气逸散的速率过快,导致烧杯内氧气的浓度过低,带火星的木条无法持续燃烧;
(6)A、5%过氧化氢溶解分解产生的氧气能使木条复燃,燃烧得更旺。A正确;
B、10%过氧化氢溶液分解产生的氧气能使木条复燃,但之后火焰变得微弱。B错误;
C、20%过氧化氢溶液分解产生的氧气能使木条复燃,但之后立即熄灭。C错误;
D、二氧化锰能加快过氧化氢的分解。D正确。
故答案为:AD。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
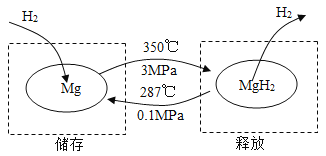
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |
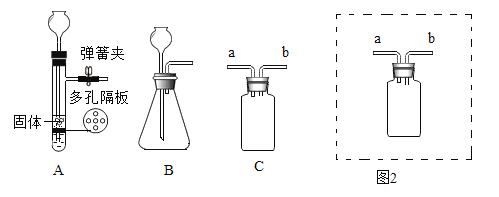
【题目】根据下图回答问题。
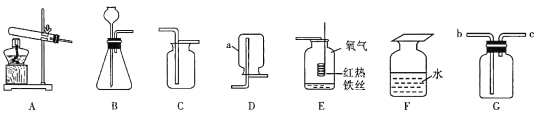
(1)仪器a的名称是_______。
(2)实验室用B装置制氧气的化学方程式为_______。装置E中发生反应的化学方程式为______
(3)实验室常使用仪器G来收集气体,若现在要收集氢气,则气体从__________(填“b”或“c”)端进入;有同学认为只要经过一定的改进措施,氧气也能从该端进入收集,则他的改进措施可能是________。
(4)探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如下表所示。已知空气中氧气的体积占1/5。
氧气体积分数/% | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容器50%的水(如图F所示),用排水法收集完氧气后,集气瓶内氧气的体积分数是__________,将带火星的木条伸入该集气瓶中,推测实验现象为______。
【题目】在下表对应的温度下,向4只盛有100g水的烧杯中,分别加入40 g KCl固体,充分溶解。KCl的溶解度曲线如下图
烧杯序号 | ① | ② | ③ | ④ | ⑤ |
温度(℃) | 20 | 30 | 40 | 50 | 60 |
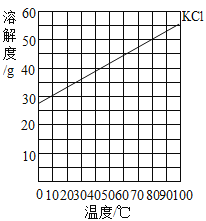
下列关于①~⑤所得溶液的说法不正确的是()
A.溶质质量①<②
B.⑤溶液通过升温会变饱和溶液
C.溶质质量分数③=④=⑤
D.④中溶质与溶剂的质量比为 2:5