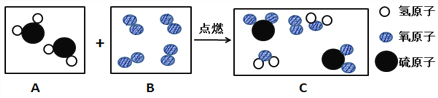
题目内容
【题目】葡萄糖存在于葡萄糖汁和其他带甜味的水果里,是一种重要的营养物质,是人类生命活动所需能量的重要来源之一,下列关于葡萄糖的说法正确的是( )

A. 葡萄糖分子中碳元素的质量分数最小
B. 葡萄糖分子由6个碳原子,12个氢原子和6个氧原子构成
C. 葡萄糖分子中C、H、O三种元素的原子个数比为1:2:1
D. 葡萄糖是多原子分子构成的有机高分子化合物
【答案】C
【解析】由题中信息知,葡萄糖化学式是C6H12O6,A、葡萄糖分子中各元素质量比是12×6∶12∶16×6=6∶1∶8,氢元素的质量分数最小,故A错误;B、一个葡萄糖分子由6个碳原子,12个氢原子和6个氧原子构成,故C错误;C、葡萄糖分子中C、H、O三种元素的原子个数比为6∶12∶6=1:2:1,故C正确;D、葡萄糖是多原子分子构成的有机化合物,不属于高分子,故D错误。
点睛∶化学式的意义∶⑴宏观意义①.表示一种物质;②表示该物质的元素组成;⑵微观意义①表示该物质的一个分子;②表示该物质的分子构成;⑶量的意义①表示物质的一个分子中各原子个数;②表示组成物质的各元素质量比。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目