题目内容
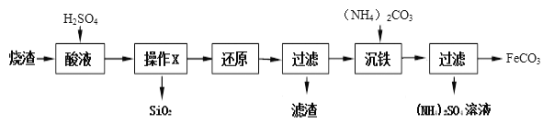
【题目】现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:提示:(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解
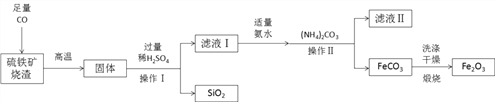
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、________等。
(2)滤液Ⅰ中主要的溶质是___________________。
(3)加适量氨水的目的是__________________________。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是__________________。
(5)滤液Ⅱ中可回收的产品是_____________(写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式_________________________。
【答案】 漏斗 FeSO4,H2SO4 除去过量的稀硫酸 温度控制在40℃以下 (NH4)2SO4 FeCO3![]() FeO+CO2↑
FeO+CO2↑
【解析】用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)。(1)操作Ⅰ、操作Ⅱ属于过滤操作,用到的玻璃仪器有玻璃棒、烧杯、漏斗等。(2) Fe2O3、FeO与一氧化碳反应生成铁,铁与稀硫酸反应生成硫酸亚铁,由于硫酸是过量的,滤液Ⅰ中主要的溶质是FeSO4,H2SO4。 (3)氨水呈碱性,加适量氨水的目的是除去过量的稀硫酸。(4)根据题中信息,加入(NH4)2CO3后,(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解,
该反应必须控制的条件是温度控制在40℃以下。(5)硫酸亚铁溶液和碳酸铵溶液反应生成碳酸亚铁沉淀和硫酸铵,滤液Ⅱ中可回收的产品是(NH4)2SO4。(6)在空气中煅烧FeCO3的化学反应方程式是FeCO3 ![]() FeO+CO2↑。
FeO+CO2↑。
点睛∶铁与稀硫酸反应生成硫酸亚铁,硫酸亚铁溶液和碳酸铵溶液反应生成碳酸亚铁沉淀和硫酸铵。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)我们已经学习了氢氧化钠的性质,知道这种固体要密封保存,原因有:①___________________;②________________。
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
【对固体猜想】
猜想I:全部是NaOH;猜想II:全部是Na2CO3;猜想III:是NaOH和Na2CO3混合物
【实验和推断】
(2)为进一步确定成分,进行了以下探究:
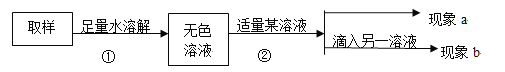
填写以下实验报告:
实验操作 | 实验现象 | 实验结论 |
第一步:用试管取约2mL该无色溶液,滴入适量澄清石灰水。 | 现象a:溶液变浑浊。 | 化学方程式:①___________, 证明有碳酸钠。 |
第二步:静置,取上层清液于另一试管中,滴入无色酚酞溶液。 | 现象b:②__________ | 证明含有NaOH,猜想III成立,是NaOH和Na2CO3混合物 |
③分析:小组中有同学提出质疑,认为以上实验不能证明猜想III成立,理由是:
a、Na2CO3溶液呈碱性; b、__________________________________________________。
(3)兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
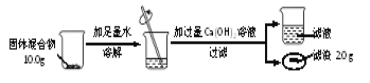
①根据题中信息______(填“能”或“不能”)计算Ca(OH)2溶液的质量分数。
②通过计算,固体混合物中Na2CO3的质量分数是__________________。
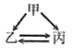
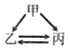
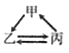
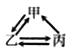
【题目】下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是
选项 | A | B | C | D | |
转化关系 |
|
|
|
| |
物质 | 甲 | H2O2 | C | CaCO3 | CuCl2 |
乙 | O2 | CO | CO2 | Cu | |
丙 | H2O | CO2 | Na2CO3 | CuO | |
A. A B. B C. C D. D
【题目】下表是日常生活中常用各种清洗剂。
名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 |
产品样式 |
|
|
|
|
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过氧化氢 |
(1)使用洗涤灵清洗餐具上的油污,这是因为它具有_____功能。
(2)清除以下物质,可使用洁厕灵的是_______(填字母序号)。
A.铁锈 B.油污 C.水垢 D.木炭还原氧化铜后,试管内壁残余的红色痕迹
(3)将洁厕灵滴入炉具清洁剂中,如图甲所示、
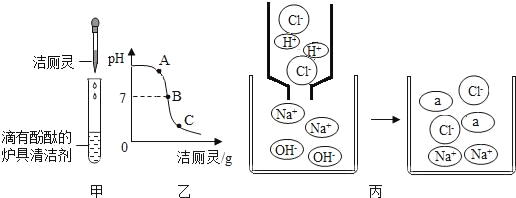
①甲中发生反应的化学方程式为______________
②若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)__________,此时溶液可用图乙中_____(选填A、B、C)点处表示。
③丙中反应没有明显现象,为证明反应发生,可加入的试剂有________。
A.无色酚酞溶液 B.硝酸钾溶液 C.硝酸银溶液 D.锌粒