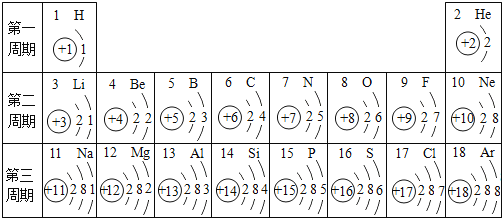
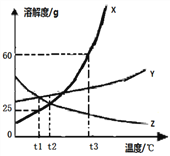
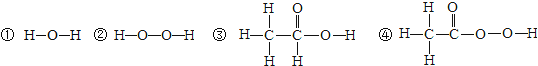题目内容
【题目】t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100水的两个烧杯中,充分搅拌并恢复到原温度后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
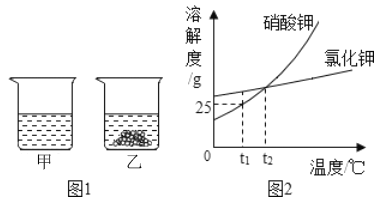
①t1℃时,KNO3的溶解度是_______g;
②烧杯甲中溶液是否达到饱和状态?___(填“是”“否”或“无法判断”);其中溶解的溶质是___;
③两种物质中溶解度受温度的变化影响较大的是___;若要提纯混有少量KCl的KNO3,采用的方法是__;
④将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水_____g;
⑤关于图中烧杯内的物质,下列说法错误的是________;
A.烧杯甲中溶液溶质的质量分数大于烧杯乙中溶液的溶质的质量分数
B.温度升高到t2℃,烧杯乙中固体一定全溶解,并成为不饱和溶液(不考虑水的蒸发)
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】 25 无法判断; 氯化钾 硝酸钾; 降温结晶 50 C
【解析】①t1℃时,KNO3的溶解度是25g。②t1℃时,氯化钾的溶解度大于硝酸钾的溶解度,所以烧杯中溶解的是氯化钾,因为不知道溶解了多少氯化钾,所以无法判断溶液是否饱和。③由溶解度曲线看出,溶解度受温度影响较大的是硝酸钾。提纯溶解度受温度影响较大的物质,采用降温结晶法。④溶液稀释过程中,溶质的质量不变,设将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水的质量是x,50g×![]() =(50g+x)×10%,解得x=50g ⑤A.两只烧杯中加入等质量的水和固体物质,甲烧杯中的物质全部溶解,乙烧杯中有固体物质剩余,所以烧杯甲中溶液溶质的质量分数大于烧杯乙中溶液的溶质的质量分数,正确;B.t2℃时,两种物质的溶解度相等,且两种物质的溶解度都随温度的升高而增大,烧杯甲的溶液变为不饱和溶液,故烧杯乙中的溶液也是不饱和溶液,所以温度升高到t2℃,烧杯乙中固体一定全溶解,并成为不饱和溶液,正确;C.一种溶剂可同时溶解多种溶质,将两个烧杯中的溶液混合,充分搅拌后,烧杯中无固体剩余,错误;D.t2℃时,两种物质的溶解度相等,将温度升高到t2℃,两烧杯内溶液都是不饱和溶液,它们溶质的质量分数相等,正确。故选C。
=(50g+x)×10%,解得x=50g ⑤A.两只烧杯中加入等质量的水和固体物质,甲烧杯中的物质全部溶解,乙烧杯中有固体物质剩余,所以烧杯甲中溶液溶质的质量分数大于烧杯乙中溶液的溶质的质量分数,正确;B.t2℃时,两种物质的溶解度相等,且两种物质的溶解度都随温度的升高而增大,烧杯甲的溶液变为不饱和溶液,故烧杯乙中的溶液也是不饱和溶液,所以温度升高到t2℃,烧杯乙中固体一定全溶解,并成为不饱和溶液,正确;C.一种溶剂可同时溶解多种溶质,将两个烧杯中的溶液混合,充分搅拌后,烧杯中无固体剩余,错误;D.t2℃时,两种物质的溶解度相等,将温度升高到t2℃,两烧杯内溶液都是不饱和溶液,它们溶质的质量分数相等,正确。故选C。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案