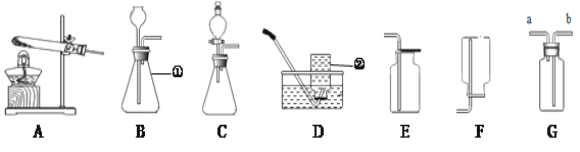
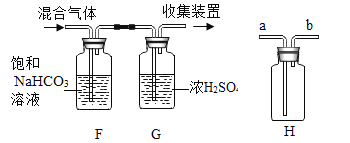
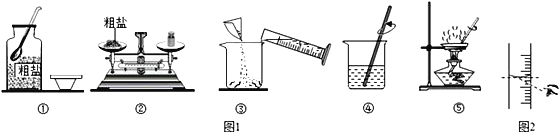
题目内容
【题目】下表是元素周期表中的一部分,请回答下列问题。

(1)氧元素与硫元素化学性质相似的原因是 _________________________________ ;
(2)写出11号和17号元素组成化合物的化学式 _________________ ;
(3)表中具有稳定结构的原子有 ______和__________ ;
(4)请写出氧的离子符号_________。
【答案】 最外层电子数相等 NaCl Ne Ar O2-
【解析】本题考查了元素周期表中元素的信息、原子结构示意图的含义。
(1)由于元素的性质主要由最外层的电子数决定的,氧元素与硫元素化学性质相似的原因是:两种原子的最外层电子数相同;
(2)原子序数为11元素为钠元素,原子序数为17的元素为氯元素,钠为+1价,氯为-1价,组成化合物的化学式为NaCl;
(3)表中He的最外层也是第一层,有2个电子,具有相对稳定结构;表中Ne和Ar的最外层有8个电子,具有相对稳定结构;
(4)氧原子的最外层有6个电子在化学反应中易得到2个电子形成稳定结构。氧的离子符号O2-。

【题目】金属材料和水在生产和生活中有着广泛应用。
① 水是很好的溶剂。下表是 NaCl 和 KNO3 在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g 水) | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
I.两种物质中,溶解度受温度影响变化较大的是______;
II.60℃时,按图示操作

A 中溶液是_______(填“饱和”或“不饱和”)溶液,C 中溶液的总质量是_______g;
III.50℃时,将两种物质的饱和溶液各 100 g,分别加热蒸发 10 g 水后,再恢复到 50℃, 则以下说法正确的是______(选填编号)。
a.有 NaCl 晶体析出,无 KNO3 晶体析出
b.两溶液中溶质与溶剂的质量比都增大
c.剩余溶液的质量:NaCl 溶液大于 KNO3 溶液 d.析出 NaCl 晶体 3.7 g
② 铁制品在潮湿空气中容易生锈,请写出工业上除铁锈的方法_________(用化学方程式表示)。
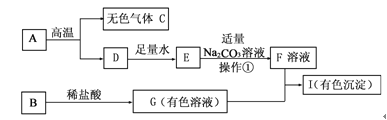
③ 某同学将一定质量的 Zn 粉放入 AgNO3 与 Cu(NO3)2 的混合溶液中,实验流程如图所示:
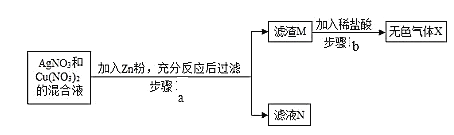
I.步骤 b 中生成的无色气体 X 是_________,滤液 N 中的溶质是_____;
II.步骤 a 中发生反应的化学方程式____(任写一个即可)。