题目内容
【题目】金属在生产、生活中应用广泛。
(1)一氧化碳还原氧化铁的方程式为__________________。冶炼 16t 氧化铁,可得到铁_______t。
(2)铝抗腐蚀性能好,是因为铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,氧化铝的化学式为_______________。
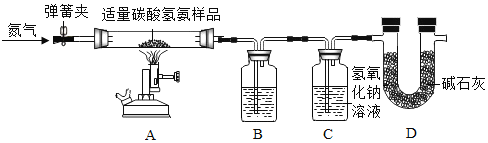
(3)黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如图所示),纯铜片上留下明显的划痕,该实验的目的是_____________________。
【答案】3CO+Fe2O3![]() 2Fe+3CO2 11.2 Al2O3 探究合金与组成它的纯金属的硬度大小
2Fe+3CO2 11.2 Al2O3 探究合金与组成它的纯金属的硬度大小
【解析】
(1)一氧化碳在高温下与氧化铁反应,生成铁和二氧化碳,故填写:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
解:设冶炼 16t 氧化铁,可得到铁的质量为x

答:冶炼 16t 氧化铁,可得到铁11.2t,故填写:11.2;
(2)氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3,故填写:Al2O3。
(3)将纯铜片和黄铜片相互刻画,纯铜片上留下明显的划痕,说明黄铜片的硬度比纯铜片大,即合金的硬度比其纯金属大,因此,该实验的目的是探究合金与组成它的纯金属的硬度大小,故填写:探究合金与组成它的纯金属的硬度大小。

【题目】碳酸镁水合物是制备镁产品的中间体。
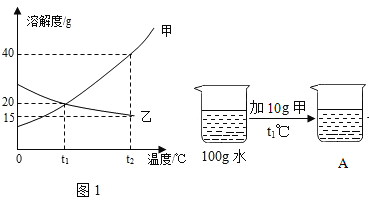
Ⅰ.(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
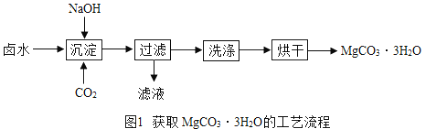
(1)沉淀过程得到了MgCO33H2O晶体和氯化钠的混合物,写出沉淀过程发生的化学反应方程式:________________________________________________。
(2)过滤需要用到的玻璃仪器有烧杯、玻璃棒和______,证明MgCO33H2O沉淀已洗涤干净的方法是,取最后一次洗涤液,_____________________________,说明已洗净。
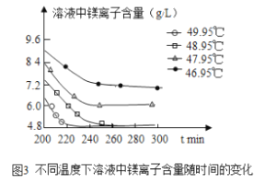
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示。
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为________,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
Ⅱ.(测定MgCO33H2O的纯度)
(查阅资料)
a.碱石灰是CaO与NaOH的固体混合物。
b.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
c.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24 MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
(实验步骤)
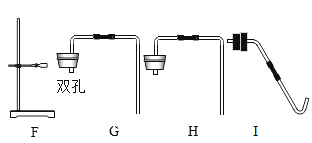
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
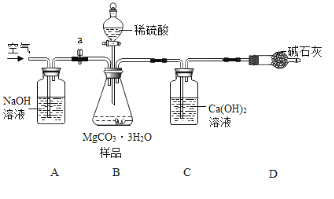

依据实验过程回答下列问题:
(1)实验结束后需持续缓缓通入空气,其作用为______________________________。
(2)C装置中反应生成CaCO3的化学方程式为_______________________;D中碱石灰的作用为_______________________________。
(3)下列各项措施中,能提高测定准确度的是_________(填标号)。
a在加入硫酸之前,应排净装置内的CO2气体
b为了缩短实验时间,快速滴加硫酸
c在B~C之间增添盛有浓硫酸的洗气装置
d在C装置左侧导管末端增添多孔球泡
e将C装置中澄清石灰水换成Ba(OH)2溶液
(4)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)。______
(5)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(O3)44H2O,则样品中MgCO33H2O的纯度___(填“偏大”“不变”或“偏小”)。
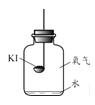
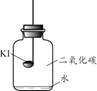
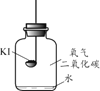
【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
【提出问题】 KI变质的条件是什么?
【查阅资料】
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
【进行实验】分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
【解释与结论】
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
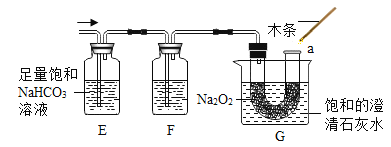
【提出问题2】CO2的作用是什么?
【进行实验】分别取10 mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2,向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | pH=8.5 | pH=6.5 | pH=4.5 |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
滴加淀粉溶液后的颜色 | 无色 | 紫色 | 深紫色 |
较长时间后,观察到试管1中溶液变为紫色。
【解释与结论】
(4)试管1实验的目的是_______。
(5)CO2在KI变质过程中的作用是_______。
【反思与评价】
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是______。
【题目】某化学兴趣小组的同学,为了比较金属 R 与铁、铜的金属活动性强弱,进行如下探究活动:
(査阅资料)铁的活动性比铜强。
(进行猜想)对三种金属的活动性顺序做出如下猜想: 猜想一:R>Fe>Cu;猜想二:_______________; 猜想三:Fe>Cu>R。
(收集证据)为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | ||
甲 | 将打磨好的R 丝插入盛有硫酸铜溶液的试管中 | ____________ | 猜想一正确 | |
乙 | 将粗细相同打磨好的 R 丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R 丝表面产生气泡速率比铁丝表面产生气泡速率_____________( 填 “快”或“慢”) | ||
丙 | 将粗细相同打磨好的 R 丝、铁丝,分别在空气中点燃 | R 丝在空气中剧烈燃烧,铁丝在空气中_______________ | ||
写出铁丝在氧气中燃烧的化学方程式:________________。
(交流反思)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
(归纳总结)他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与______________是否反应。