��Ŀ����
����Ŀ��Ϊ�ⶨij��ͭ(Cu��Zn�Ͻ�)��Ʒ��п������������ijѧϰС�����������ʵ�飺ȡ20g��ͭ��Ʒ����������ձ��У�Ȼ���80gϡ������Ĵμ����ձ��У��䷴Ӧ��������±���ʾ��
���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
����ϡ���������/g | 20 | 20 | 20 | 20 |
ʣ���ͭ��Ʒ������/g | 17.4 | 14.8 | m | 13.2 |
(1)���е�m��ֵΪ___��
(2)�˻�ͭ��Ʒ��п����������Ϊ___��
(3)����ϡ�������ʵ�����������____(д���������)��
���𰸡�13.2 34% 19.6%
��������
(1)���ݱ������ݣ�20gϡ����������Ļ�ͭ��п������Ϊ��20g��17.4g=2.6g��14.8g��13.2g=1.6g����֪�����μ���������Ѿ��������ʱ��е�m��ֵΪ13.2g��
(2) �˻�ͭ��Ʒ��п����������Ϊ��![]()
(3)�裺�μӷ�Ӧ�����������Ϊx
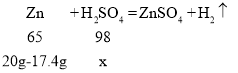
![]()
x��3.92g
����ϡ�������������Ϊ��![]() ��100%��19.6%��
��100%��19.6%��
������ϡ�������������Ϊ19.6%��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����ݱ������ݻش��������⡣
| 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
(1)���ӽ����͵ij���ʯ��ˮ��Ϊ���ͣ����������ʵķ������⣬������ͨ��___��____�ﵽ��
(2)�����ϱ��ƶ���������Ȼ����ܽ�����ʱ���¶ȷ�Χ��____��
(3)��20����������Ʊ�����Һ�м���������ʯ�ң�����ȴ��20�棬��ʱ��Һ�����ʵ������ȼ�����ʯ��ǰ��Һ�����ʵ�����____(��������������������������С��)��
(4)20��ʱ���Ȼ��Ʊ�����Һ�����ʵ���������Ϊ____(���������0.1%)��
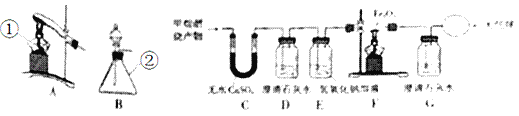
����Ŀ��ij��ȤС���KClO3�ֽⷴӦ�Ĵ�������̽��������ͬ�ļ��������£�����ͼװ����ɱ���ʵ�飺
��� | KClO3����/g | ���� | ��������/g | �ռ�50 mLO2����ʱ��/s |
ʵ��1 | 5 | �� | �� | 171 |
ʵ��2 | 5 | MnO2 | 0.5 | 49 |
ʵ��3 | 5 | Fe2O3 | 0.5 | 58 |
ʵ��4 | 5 | KCl | 0.5 | 154 |
��1������ʵ��1��Ŀ����______________��
��2����������3�ִ����Ĵ�Ч����ѵ���______________�����������ƣ���������Ϊ_____________ɫ���塣д��KClO3�ڸ����ʴ������ȷֽ�ķ��ű���ʽ��__________________��
��3��KClO3��ClԪ�صĻ��ϼ�Ϊ_______________����д��KClO3�е�������_____________��
��4����ʵ��1��ʵ��4��֪��KCl__________�������������������������á�ά�ּ����������䣬��ʵ��1�ټ����ռ�50 mL O2������ʱ����������171 s������ԭ��______________��
��5��Ҫ�Ƚ�KClO3�ֽⷴӦ�в�ͬ�����Ĵ�Ч�������˲����ռ�50 mL O2����ʱ���⣬�����Բ�����ͬʱ����_____________��
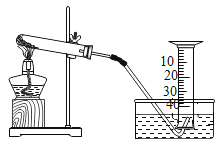
����Ŀ����ͼ1�ǸĽ��ĵ��ˮ��ʵ��װ��ʾ��ͼ����ͼ2�ǿα��е��ˮ��ʵ��װ��ʾ��ͼ�����ͼ�ش��������⣺
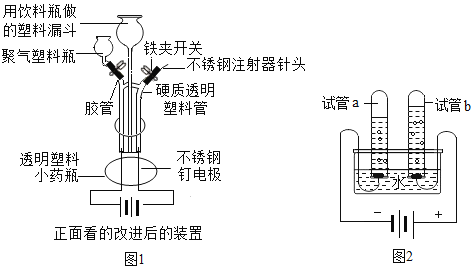
��1��ͨ��һ��ʱ���ͼ2��a�Թ������������a_____��a��b�������֮��ԼΪ_____����ij�ε��ˮ��ʵ���в���˷ֱ����Դ�������������������������ϲ����������ʵ���������£�
ʱ�䣨���ӣ� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
�����������������cm3�� | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
�����������������cm3�� | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
��ϸ��������ʵ�����ݣ�1��6�������������������ɵ��������֮�ȴ���2�Ul�����ܵ�ԭ����_____��
��2���ò�����ͨ�ܽ�ͼ1װ�õ��ˮʱ��������������һ�𣬵�ȼ�øû���������ķ�����ʱ��ʵ�������ǣ�_____
��3��д�����ˮ�����ֱ���ʽ��_____