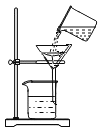
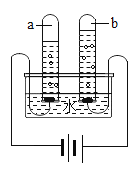
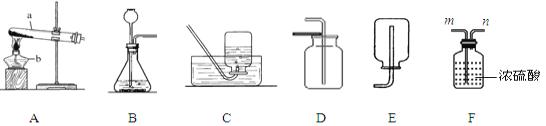
��Ŀ����
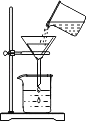
����Ŀ����ͼ��A��F�dz��л�ѧ���������ʡ��ڳ����£�C��D�����壬A��B��Һ�壬E�ǹ��壻���A��B��Ԫ��������ͬ��ͼ����һ����ʾ���˵����ʼ��ܷ�����ѧ��Ӧ����������ʾ���ʼ����ת����ϵ������Ӧ���������ַ�Ӧ�������������ȥ��

��1��д��D�Ļ�ѧʽ_____��;_____��
��2��д����Ӧ�ı���ʽ��A��B��_____���������Ӧ����Ϊ_____��
��3����EΪ��˿����C��ȼ�յ�����_____��
��4��д����һ������C-E��Ӧ�ı���ʽ��_____��
���𰸡�H2 ��������ȼ�ϡ�ұ������ ![]() �ֽⷴӦ ����ȼ�գ��������䣬���ȣ����ɺ�ɫ����
�ֽⷴӦ ����ȼ�գ��������䣬���ȣ����ɺ�ɫ���� ![]()
��������
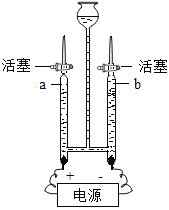
����A-F�dz��л�ѧ���������ʣ��ڳ����£�C��D�����壬A��B��Һ�壬E�ǹ��壬���A��B��Ԫ��������ͬ�� Aת���ɵ�B��ת����C������A�ǹ���������Һ��B��ˮ��C����������EΪ��˿�����������ڵ�ȼ������������������������ˮת���ɵ�D����������Ӧ������D��������������֤���Ƶ���ȷ��
��1���з�����֪DΪ��������ѧʽΪ��H2���������п�ȼ�ԣ�����ȼ�ϣ���Ϊ����ȶ࣬��Դ�㣬����Ⱦ����һ��������ĸ���ȼ�ϣ��������л�ԭ�ԣ����Կ�����ұ��������
��2��A��B�ķ�Ӧ�ǹ��������ڶ������̵Ĵ������·ֽ�����ˮ������������ʽΪ��![]() ���÷�Ӧ�������ǡ�һ��ࡱ���ʷ�Ӧ������Ϊ�ֽⷴӦ��
���÷�Ӧ�������ǡ�һ��ࡱ���ʷ�Ӧ������Ϊ�ֽⷴӦ��
��3����˿��������ȼ�յ������Ǿ���ȼ�գ��������䣬���ȣ����ɺ�ɫ���壻
��4��E��������������������ȼ�յķ�Ӧ����ʽΪ��![]() ��
��

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ��ijʵ��С��Թ�������ֽⷴӦ����̽����
��̽��һ��̽��Ӱ���������ֽ���������ء�ʵ�鲽�輰�������£�
�ֱ�ȡ5mLH2O2��Һ����ʵ�飬�ⶨ����4mLO2����ʱ�䣬ʵ������¼���£�
ʵ����� | H2O2��Һ��Ũ�� | �¶ȡ� | MnO2��ĩ����/g | ��Ӧʱ�� |
�� | 30 | 35 | 0 | t1 |
�� | 30 | 55 | 0 | t2 |
�� | 5 | 20 | 0.1 | t3 |
�� | 15 | 20 | 0.1 | t4 |
��1���ԱȢ٢�����ʵ�飬��t1>t2����ɵó��Ľ�����:_____��
��2����˵����������ֽ��������Ũ���йص�ʵ����_____����ʵ����ţ���
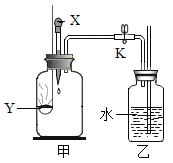
��̽������̽����������Fe2O3���ܷ�������������Һ�ֽ�Ĵ���?����ܣ����Ч�����?ʵ�鲽�輰�������£�
ʵ�鲽�� | ʵ������ |
��.�ֱ���ȡ5mL5%����������Һ����A��B��֧�Թ��У���A�Թ��м���0.5g��������ĩ�����������ǵ�ľ���ֱ�����A��B��֧�Թ��У��۲����� | A�Թ��в����������ݣ������ǵ�ľ����ȼ��_____ |
��.��A�Թ���û��������ʱ�����¼������������Һ�����ѻ��ǵ�ľ�������Թ��У��۲����� | �Թ��в����������ݣ������ǵ�ľ����ȼ�� |
��.��ʵ�����û������ʱ�����Թ��еķ�Ӧʣ������ˣ���������ϴ�ӡ���������� | ���ù�������Ϊ_____g�� |
��.�ֱ���ȡ5mL5%����������Һ����C��D��֧�Թ��У���C�Թ��м���0.5g��������ĩ����D�Թ��м���0.5g�������̷�ĩ���۲����� | ���� |
��1�������������ʵ��̽���б����ʵ������_____����_____g��
��2����������������⣺
��ʵ����ۣ�
��ʵ��II��III֤��_____��������������������������������ֽ�Ĵ�����
��д������������������ֽ�ķ��ű���ʽ_____��
��ʵ�����ۣ�
��ʵ�����IV��Ŀ����_____��
��ʵ����չ��
�ܲ������ϵ�֪������ͭ������ͭ�����Ρ���������Ҳ����������������Һ�ֽ�Ĵ����������йش�����˵������ȷ����_____��
A ��������ֻ��������������Һ�ֽ�Ĵ���
B ͬһ����ѧ��Ӧ�����ж��ִ���
C ����ֻ�ܼӿ컯ѧ��Ӧ������
D ��������������Ҳ������������Ӧ�ķ�Ӧ���������
����Ŀ��Ϊ�ⶨij��ͭ(Cu��Zn�Ͻ�)��Ʒ��п������������ijѧϰС�����������ʵ�飺ȡ20g��ͭ��Ʒ����������ձ��У�Ȼ���80gϡ������Ĵμ����ձ��У��䷴Ӧ��������±���ʾ��
���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
����ϡ���������/g | 20 | 20 | 20 | 20 |
ʣ���ͭ��Ʒ������/g | 17.4 | 14.8 | m | 13.2 |
(1)���е�m��ֵΪ___��
(2)�˻�ͭ��Ʒ��п����������Ϊ___��
(3)����ϡ�������ʵ�����������____(д���������)��