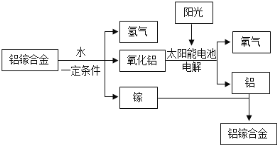
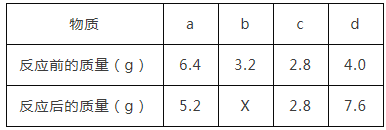
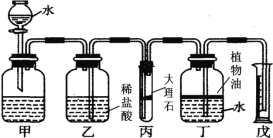
题目内容
【题目】碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ.以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧:高温煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为________。
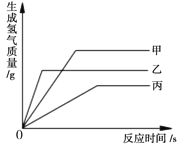
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO + H2O2 = MgO2+H2O,温度升高,说明该反应________热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(![]() )的影响分别如图1所示,则最佳的煅烧温度为________℃、煅烧时间_______小时。
)的影响分别如图1所示,则最佳的煅烧温度为________℃、煅烧时间_______小时。

(3)分离:得到产品。
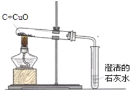
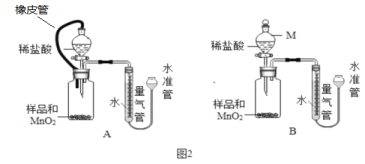
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数.
已知:a. MnO2与稀盐酸不反应 b. MgO2+2HCl = MgCl2+H2O2
c. 2MgO2![]() 2MgO+O2↑ d. MgO+C
2MgO+O2↑ d. MgO+C![]() Mg+CO↑
Mg+CO↑
①仪器M 的名称是_______________,MnO2的作用是__________。
②相同条件下,装置______能使测定结果更准确。(填图2 中“装置A”或“装置B”)
③经讨论,该小组又设计了下列2种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是__________(填序号)。
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
Ⅱ.MgCl2是制备Mg2(OH)2CO3的原料,工业上通常用碳酸镁来制备MgCl2,反应如下:MgCO3 + Cl2 + CO![]() MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的碳酸镁多少吨_____?(写出计算过程)。
MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的碳酸镁多少吨_____?(写出计算过程)。
【答案】Mg2(OH)2CO3![]() 2MgO + H2O + CO2↑ 放出 650 2 分液漏斗 催化作用 A a 16.8t
2MgO + H2O + CO2↑ 放出 650 2 分液漏斗 催化作用 A a 16.8t
【解析】
Ⅰ、(1)镁元素对应的氧化物是氧化镁,氢元素对应的氧化物是水,使澄清石灰水变浑浊的气体是二氧化碳,碱式碳酸镁在高温条件下反应生成氧化镁、水和二氧化碳,故反应的化学方程式写为:Mg2(OH)2CO3![]() 2MgO + H2O + CO2↑。
2MgO + H2O + CO2↑。
(2)反应后温度升高,说明该反应是一个释放热量的反应,故填放出;
由图可知,MgO2产率最高时的温度为650℃,故填650;
由图可知,MgO2产率最高时的煅烧时间为2小时,故填2。
(4)①仪器M 的名称是分液漏斗,故填分液漏斗;
MnO2与稀盐酸不反应,其出现在反应中就是作催化剂,起催化作用,故填催化作用。
②装置A是一密闭装置,使反应在密闭装置中反应,没有外界因素的影响,结果更准确,故填A。
③a、加热使MgO2完全分解,测出剩余固体质量,可以根据质量差为生成的氧气的质量求出MgO2的质量,进而确定MgO2的质量分数,选项正确;
b、由于氧化镁和过氧化镁都能和碳反应,无法确定过氧化镁生成的镁的质量,也无法求算MgO2的质量分数,选项错误,故选a。
Ⅱ、解:设需要碳酸镁的质量为x
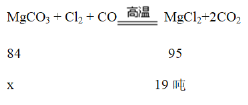
84:95=x:19t
x=16.8t
答:需要碳酸镁的质量为16.8吨。

【题目】某小组同学为探究二氧化锰对过氧化氢分解速度的影响,设计了以下实验:
(1)完善实验一、实验二:
实验步骤 | 实验现象 | 实验结论 | |
实验一 |
| 带火星的木条不复燃 | 过氧化氢分解的速率较慢 |
实验二 |
| ___________ | ________ |
(2)实验三:待实验二结束,剩余的液体化学式为_____,倒出多余液体,继续向其中加入5%的过氧化氢溶液,实验现象为____________,得出结论__________,写出此时的反应方程式__________;
(3)实验四,实验之前称量加入二氧化锰的质量为m1,待实验三结束后,取出二氧化锰,干燥后称量质量为m2,则m1_____m2(填“>”、“<”、“=”),得出结论___________,从液体中取出二氧化锰的操作名称为______;