题目内容
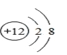
【题目】(1)如图是某金属元素形成微粒的结构示意图,该金属在空气中燃烧时放出大量的热,并发出耀眼的白光。该金属元素原子核外电子数 = ______;其所示微粒的符号为________;
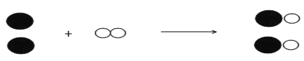
(2)下图是该反应的微观示意图。如图所示的该金属在空气中燃烧时反应的化学方程式为____________
(3)决定元素种类的是(_________)
A.质子数 B.电子数 C.中子数 D.最外层电子数
(4)下列微粒中,质子数少于核外电子数的是(______)
A.OH﹣ B.Fe2+ C.HCl D.H2O2
【答案】12 Mg2+ 2Mg+O2![]() 2MgO A A
2MgO A A
【解析】
(1) 由该微粒的结构示意图可知,该金属元素原子核内质子数是12,在原子中核内质子数等于核外电子数;所以,该金属元素原子核外电子数是12;图一所示微粒是镁离子,符号为:Mg2+;
(2) 该金属为镁,在空气中与氧气反应生成氧化镁,符合反应的微观示意图,反应的化学方程式为:2Mg+O2![]() 2MgO;
2MgO;
(3) A、决定元素的种类的是质子数(即核电荷数),故选项正确;
B、决定元素的种类的是质子数(即核电荷数),不是电子数,故选项错误;
C、决定元素的种类的是质子数(即核电荷数),不是中子数,故选项错误;
D、决定元素的种类的是质子数(即核电荷数),不是最外层电子数,故选项错误;
(4) A、OH-带1个单位的负电荷,质子数<核外电子数,故选项正确;
B、Fe2+带2个单位的正电荷,质子数>核外电子数,故选项错误;
C、HCl分子是由氢原子和氯原子构成的,不显电性,质子数=核外电子数,故选项错误;
D、H2O2分子是由氢原子和氧原子构成的,不显电性,质子数=核外电子数,故选项错误。

【题目】密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是( )
物质 | X | O2 | CO2 | H2O |
反应前质量/g | 16 | 70 | 1 | 0 |
反应后质量/g | 0 | 待测 | 45 | 36 |
A. 该反应为分解反应 B. 反应生成的CO2和H2O的质量比为45:36
C. 表中“待测”值为5 D. X中一定含有碳、氢两种元素