题目内容
【题目】某小组同学为探究二氧化锰对过氧化氢分解速度的影响,设计了以下实验:
(1)完善实验一、实验二:
实验步骤 | 实验现象 | 实验结论 | |
实验一 |
| 带火星的木条不复燃 | 过氧化氢分解的速率较慢 |
实验二 |
| ___________ | ________ |
(2)实验三:待实验二结束,剩余的液体化学式为_____,倒出多余液体,继续向其中加入5%的过氧化氢溶液,实验现象为____________,得出结论__________,写出此时的反应方程式__________;
(3)实验四,实验之前称量加入二氧化锰的质量为m1,待实验三结束后,取出二氧化锰,干燥后称量质量为m2,则m1_____m2(填“>”、“<”、“=”),得出结论___________,从液体中取出二氧化锰的操作名称为______;
【答案】有气泡产生,带火星的小木条复燃 二氧化锰能加快过氧化氢溶液的分解速率 H2O 有气泡产生 二氧化锰反应前后化学性质不变 2H2O2![]() 2H2O + O2 ↑ = 化学反应前后二氧化锰质量不变 过滤
2H2O + O2 ↑ = 化学反应前后二氧化锰质量不变 过滤
【解析】
(1)因为二氧化锰能加快过氧化氢的分解速率,过氧化氢溶液中加入二氧化锰能迅速产生氧气,所以实验现象是有气泡产生,带火星的小木条复燃,根据此实验现象可知,二氧化锰能加快过氧化氢溶液的分解速率。
(2)过氧化氢发生分解反应生成水和氧气,氧气逸出,所以待实验二结束,剩余的液体是水。催化剂在反应前后化学性质不变,所以倒出多余液体,继续向其中加入5%的过氧化氢溶液,试管中又有大量气泡冒出,所以实验现象为有气泡产生,由此得出结论二氧化锰反应前后化学性质不变,过氧化氢在二氧化锰作催化剂的条件下发生分解反应生成水和氧气。
(3)催化剂在反应前后质量不变,所以化学反应前后二氧化锰质量不变。通过过滤可将难溶性的固体与液体分离。

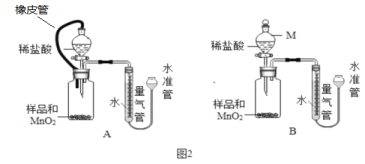
【题目】根据下列实验装置图,回答有关问题。
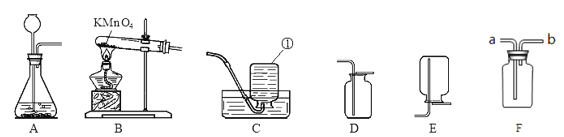
(1)图中标有①的仪器名称是______________。
(2)实验室制取氢气应选择的发生装置是__________,若要获得较纯净的氢气,应选择的收集装置是__________。为保证安全,点燃氢气前,应进行的操作是_____________。
(3)实验室利用过氧化氢溶液和二氧化锰制氧气,反应的化学方程式为__;若用B装置作制氧气的发生装置,应进行的改进是__________;反应的化学方程式为_________;若用装置F收集氧气,则气体应从导管_______(填“a”或者“b”)端通入;实验结束时应先移出导管再熄灭酒精灯,若操作顺序相反,则可能造成___________。
(4)排水法收集与排空气法收集二氧化碳的比较(分别用体积相同的两个集气瓶收集)
已知:CO2+H2O+CaCO3==Ca(HCO3)2,Ca(HCO3)2能溶于水。
比较项目 | 排水法 | 向上排空气法 |
收集方法可行性分析 | 因为CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率,所以可以用排水法收集 | 因为________,所以可用向上排空气法收集 |
收集过程分析 | 集满现象:____________ | “验满”因气体无色,故集满与否较难确定,即便用燃着的木条移近容器口火焰熄灭,也难以证明空气完全排尽 |
向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后澄清所需时间较短 | 先浑浊后澄清所需时间较长 |
由上述实验可得结论 | 与排空气法相比,排水法的优点是__________ | |
【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是____________________________。
(2)反应中产生氧气的质量是_________。
(3)求样品中高锰酸钾的质量分数_________。
(4)该反应中转化为氧气的氧元素质量占高锰酸钾中氧元素质量的________%。