题目内容
【题目】密闭容器中盛有CH4和O2的混合气体,点燃使其充分反应,CH4全部转化为CO、CO2和H2O,待容器恢复至室温,测得容器内混合气体中碳元素的质量分数为36%.则反应前CH4和O2的质量比为( )
A. 4:13 B. 3:10 C. 2:7 D. 1:4
【答案】B
【解析】假设反应后该混合气体的质量为100g.则混合气体中含碳元素100g×36%=36g,其中氧元素的质量为100g﹣36g=64g,根据元素的守恒,可知甲烷中碳元素的质量为36g,则甲烷的质量为 =48g,甲烷中氢元素的质量为48g×
=48g,甲烷中氢元素的质量为48g×![]() =12g,甲烷燃烧时,其中的氢元素转化为水中的氢元素.则反应后生成水的质量为
=12g,甲烷燃烧时,其中的氢元素转化为水中的氢元素.则反应后生成水的质量为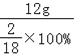 =108g,反应后生成水中的氧元素的质量为108g﹣12g=96g,根据质量守恒定律,则氧气的质量=64g+96g=160g。则反应前CH4和O2的质量比为48g:160g=3:10,故选B。
=108g,反应后生成水中的氧元素的质量为108g﹣12g=96g,根据质量守恒定律,则氧气的质量=64g+96g=160g。则反应前CH4和O2的质量比为48g:160g=3:10,故选B。

练习册系列答案
相关题目
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共5.0 g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
剩余固体质量/g | 4.55 | 3.75 | 3.30 | 3.08 | 3.08 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为________g;
(2)原混合物中氯酸钾的质量分数是多少?(精确到0.1%)