题目内容
【题目】甲同学对有关盐的知识进行了以下的整理.
(1)填写下表空格中的化学式:
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
______ | CaCl2 | NaCl | MgCl2 | AlCl3 | ______ | ______ | ______ |
反思:①以上盐中的金属元素的排列,可以得出是依据____顺序归纳整理的.
②酸在水溶液中能解离出共同的H+,因此酸溶液具有相似的化学性质;碱在水溶液中能解离出共同的OH-,因此碱溶液也具有相似的化学性质.请据此分析上述盐溶液是否会具有相似的化学性质?____为什么?_____
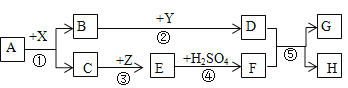
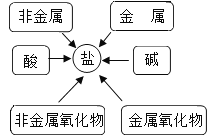
(2)甲同学通过查阅资料,发现许多反应都有盐类物质生成.他将这些知识间相互关系整理成图.验证:请写出下列有盐生成的部分化学方程式:
①用稀硫酸除铁锈_____;
②盐酸和氢氧化钠反应_____;属于____反应
③古代记载的湿法冶金技术有“曾青得铁则化为铜”,其中“曾青”是指硫酸铜溶液,化学方程式为_____;属于_____反应.
(3)甲同学在整理碳酸盐知识时,探究实验室用碳酸钙粉末、碳酸钠或碳酸氢钠,制取CO2的方法.
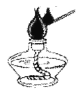
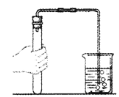
提出问题:实验室通常使用下列装置![]() 制取二氧化碳,此装置不适合用碳酸钙粉末、碳酸钠或碳酸氢钠作反应物的原因是_____.
制取二氧化碳,此装置不适合用碳酸钙粉末、碳酸钠或碳酸氢钠作反应物的原因是_____.
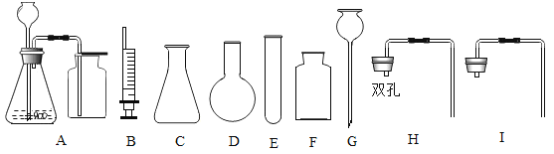
实验设计:通过控制反应物的用量来得到平稳的CO2气流的目的.因此,用碳酸盐粉末制取CO2的发生装置,可以选择_____(填仪器编号)组装.
(4)向16.8g碳酸氢钠粉末中,缓缓加入100g稀盐酸,如恰好完全反应,计算生成CO2的质量和反应前稀盐酸中溶质的质量分数_____.(请在答卷纸上写出计算过程)
【答案】KCl ZnCl2 FeCl2 CuCl2 金属活动性 有相似的化学性质 因为溶液中都解离出共同的Cl- 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O HCl+NaOH=NaCl+H2O 复分解 Fe+CuSO4=Cu+FeSO4 置换 产生CO2的速率太快,不适合实验室收集CO2气体 B、C、I(或:BDI、BEI) 7.3%
【解析】
(1) 根据物质的名称及元素的化合价正确写出物质的化学式分别为:
钾元素的化合价为+1,氯元素的化合价为-1,利用十字交叉法,氯化钾的化学式为:KCl;
锌元素的化合价为+2,氯元素的化合价为-1,利用十字交叉法,氯化锌的化学式为:ZnCl2;
氯化亚铁中铁元素的化合价为+2,氯元素的化合价为-1,利用十字交叉法,氯化亚铁的化学式为:FeCl2;
氯化铜中铜元素的化合价为+2,氯元素的化合价为-1,利用十字交叉法,氯化铜的化学式为:CuCl2 ;
①由盐中的金属元素的排列即K、Ca、Na、Mg、Al、Zn、Fe、Cu不难看出是按金属的活动性由强到弱的顺序排列;
②由于这些可溶性盐中都含有氯离子,因此它们具有相似的化学性质;
(2) ①稀硫酸能够和铁锈中的氧化铁反应生成硫酸铁和水,反应的化学方程为3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
②盐酸能和氢氧化钠溶液发生中和反应生成氯化钠和水,反应的化学方程为HCl+NaOH=NaCl+H2O;此反应属于复分解反应;
③铁的化学性质比铜活泼,因此铁可以和硫酸铜溶液反应得到铜,反应的化学方程为Fe+CuSO4=Cu+FeSO4;此反应属于置换反应;
(3) 提出问题:由于碳酸钙粉末、碳酸钠或碳酸氢钠和稀盐酸反应时速度过快,不利于气体的收集;
实验设计:通过注射器来控制盐酸的滴加速率,可得到平稳的CO2气流,根据反应条件和反应物的状态,可以用仪器:B、C、I(或:BDI、BEI);
(4)设生成CO2的质量为x,稀盐酸中溶质的质量为y,
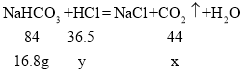
![]() x=8.8g,
x=8.8g,
![]() y=7.3g,
y=7.3g,
稀盐酸中溶质的质量分数为![]() ×100%=7.3%,
×100%=7.3%,
答:生成CO2的质量为8.8g,稀盐酸中溶质的质量分数为7.3%。