题目内容
【题目】物质的用途和使用方法等与其性质密切相关。
(1)铁粉常用于食品的保鲜剂,其原因是________________。
(2)生石灰常用作食品干燥剂,用化学方程式表示其原因是________________。
(3)浓硫酸是无色黏稠液体,有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它作除湿剂,原因是________________。
【答案】铁粉与水和氧气反应 ![]() 浓硫酸具有很强的腐蚀性
浓硫酸具有很强的腐蚀性
【解析】
(1)食品在与氧气接触时容易发生缓慢氧化而变质,铁粉能吸收空气中的氧气和水蒸气,从而延长保质期,常用于食品的保鲜剂;
(2)生石灰与水反应生成氢氧化钙,可作干燥剂,化学方程式为:CaO+H2O=Ca(OH)2;
(3)浓硫酸是无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂,浓硫酸具有很强的腐蚀性,日常生活中很少用。

【题目】甲同学对有关盐的知识进行了以下的整理.
(1)填写下表空格中的化学式:
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
______ | CaCl2 | NaCl | MgCl2 | AlCl3 | ______ | ______ | ______ |
反思:①以上盐中的金属元素的排列,可以得出是依据____顺序归纳整理的.
②酸在水溶液中能解离出共同的H+,因此酸溶液具有相似的化学性质;碱在水溶液中能解离出共同的OH-,因此碱溶液也具有相似的化学性质.请据此分析上述盐溶液是否会具有相似的化学性质?____为什么?_____
(2)甲同学通过查阅资料,发现许多反应都有盐类物质生成.他将这些知识间相互关系整理成图.验证:请写出下列有盐生成的部分化学方程式:
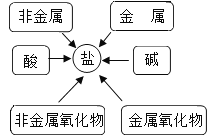
①用稀硫酸除铁锈_____;
②盐酸和氢氧化钠反应_____;属于____反应
③古代记载的湿法冶金技术有“曾青得铁则化为铜”,其中“曾青”是指硫酸铜溶液,化学方程式为_____;属于_____反应.
(3)甲同学在整理碳酸盐知识时,探究实验室用碳酸钙粉末、碳酸钠或碳酸氢钠,制取CO2的方法.
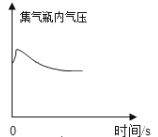
提出问题:实验室通常使用下列装置![]() 制取二氧化碳,此装置不适合用碳酸钙粉末、碳酸钠或碳酸氢钠作反应物的原因是_____.
制取二氧化碳,此装置不适合用碳酸钙粉末、碳酸钠或碳酸氢钠作反应物的原因是_____.
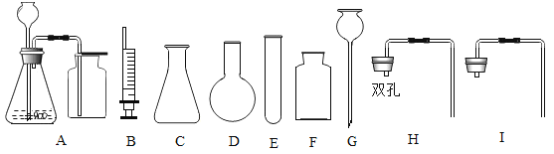
实验设计:通过控制反应物的用量来得到平稳的CO2气流的目的.因此,用碳酸盐粉末制取CO2的发生装置,可以选择_____(填仪器编号)组装.
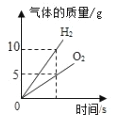
(4)向16.8g碳酸氢钠粉末中,缓缓加入100g稀盐酸,如恰好完全反应,计算生成CO2的质量和反应前稀盐酸中溶质的质量分数_____.(请在答卷纸上写出计算过程)
【题目】同学们运用对比的学习方法探究碱的性质。
实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
|
|
|
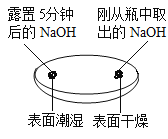
(1)由实验一、二可知,氢氧化钠会吸收空气中的______________,因此要密封保存。
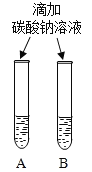
(2)实验三中观察到3个塑料瓶变瘪的程度为A>B>C,对比A瓶与_____ (填“ B”或“C” )瓶的实验现象,可证明CO2能与NaOH发生反应。
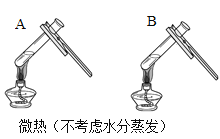
(3)同学们设计如下两种方案鉴别氢氧化钠和氢氧化钙两种饱和溶液。
方案一 | 方案二 | 分析 |
|
| 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为_____________;方案二的设计原理是___________________。 |
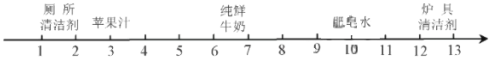
(4)某同学发现工业上使用的氢氧化钠固体标签如右图所示,于是对其成分进行了探究:

[提出问题]氢氧化钠中含有什么杂质?
[查阅资料]①在化工生产中,原料往往不能完全转化为产品。
②工业上制取NaOH的反应原理是:  ,然后蒸发溶剂获得NaOH固体。
,然后蒸发溶剂获得NaOH固体。
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
[提出猜想]氢氧化钠中含有的杂质为碳酸钠和氯化钠。
提出上述猜想的理由是_____________________________。
[进行实验]取固体于试管中,加水溶解并向溶液中加入过量稀盐酸。
[实验结论]溶液中有明显现象,证明杂质中一定含有碳酸钠。
[反思评价]该同学想进一步证明固体中含有氢氧化钠,实验方案是________________________。
(5)某碳酸钠样品中含有少量氯化钠。现称量11 g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1 g氯化钠固体。计算:
①碳酸钠样品中碳酸钠的质量_________;
②反应后所得溶液中溶质的质量分数_________。(结果精确到0. 1% )
【题目】学习盐的化学性质时,进行了如图所示的实验(提示:氯化钙、氯化钡的溶液都呈中性):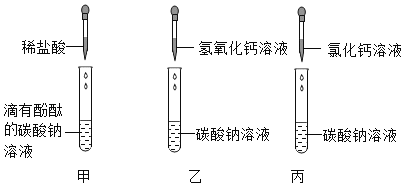
(1)碳酸钠是一种重要的盐,甲中碳酸钠溶液中加入酚酞,溶液显_____色;乙中发生反应的化学方程式是______________________。
(2)实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,过滤,得到滤液,滤液中一定不含有_______。
(3)对滤液中溶质进行探究。
(实验猜想)所得滤液中溶质可能为:
猜想一:NaCl、Na2CO3; 猜想二:NaCl、CaCl2
猜想三:NaCl、Na2CO3和NaOH; 猜想……
小明提出猜想二一定不成立,原因是_____________________________。
(实验设计)
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,加入过量BaCl2溶液 | ____________ | 猜想三成立 |
(实验分析)在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_______。