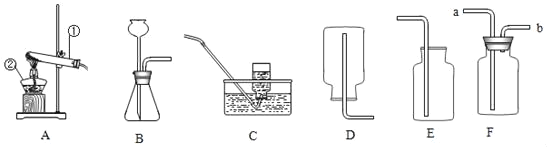
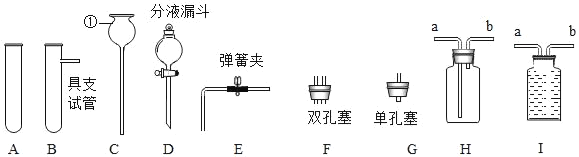
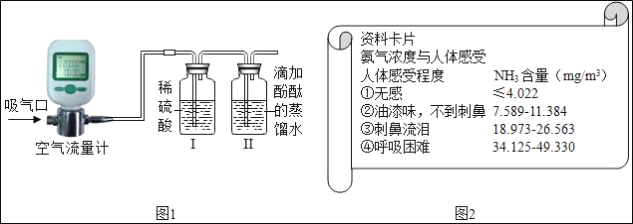
题目内容
【题目】用“盐酸﹣硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH溶液吸收H2S制取Na2S(硫化钠又称臭碱、臭苏打、黄碱),其中反应的化学方程式为:H2S+2NaOH=Na2S+2H2O
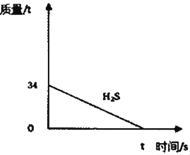
(1)若某化工厂每天要处理34吨H2S,需消耗氢氧化钠溶液中的溶质NaOH多少吨_____?(写出计算过程)
(2)如图已经画出处理34吨H2S的质量变化曲线,请在图中画出生成物Na2S质量的变化曲线,并在纵坐标上标明相应的质量_____。
(3)表中是回收H2S工艺的各项生产成本:
项目 | 单价(万元/吨) |
NaOH | 0.25 |
Na2S | 0.5 |
辅助费用(以处理1吨H2S计) | 0.12 |
工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理34吨H2S的方法能盈利_____万元。
【答案】80t 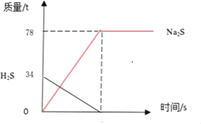 14.92
14.92
【解析】
(1)根据硫化氢和氢氧化钠反应生成硫化钠和水,依据硫化氢的质量进行计算;
(2)根据硫化氢和氢氧化钠反应生成硫化钠和水,随着反应的进行,硫化氢质量逐渐减小,硫化钠的质量逐渐增大进行分析;
(3)根据回收H2S工艺的各项生产成本,和产物的利润进行计算。
解:(1)设处理34吨的硫化氢,需要氢氧化钠的质量为x,
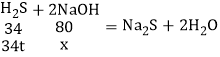
![]()
x=80t,
(2)硫化氢和氢氧化钠反应生成硫化钠和水,随着反应的进行,硫化氢质量逐渐减小,硫化钠的质量逐渐增大,所以:
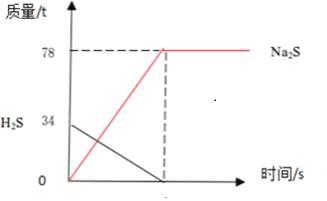
(3)0.5×78﹣(0.25×80+0.12×34)=14.92万元。

【题目】液化石油气是家庭常用燃料,主要成分是丙烷和丁烷.
性质 物质 | 熔点/℃ | 沸点/℃ | 燃烧反应 |
丙烷 | ﹣189.7 | ﹣42.1 | C3H8+5O2 |
丁烷 | ﹣138.4 | ﹣0.5 | 2C4H10+13O2 |
(1)由上表资料分析,丙烷和丁烷的物理性质是:常温常压下呈_____态(填“气”、“液”或“固”);化学性质是:具有_____ 性.
(2)液化石油气燃烧需要大量的氧气,根据化学方程式计算:59g丁烷充分燃烧所需要的氧气的质量_____.
(3)已知含碳气体的含氢量越高,相同条件下充分燃烧时产生CO2就越少. 比较甲烷、丙烷和丁烷分子中氢的质量分数,看出最洁净的燃料是_____(填化学式).
(4)气体燃料具有价廉、使用方便等优点,但使用时应特别注意安全问题.
①若灶具上的风板调节不好,空气供应不足,燃烧不充分,其后果是_____、_____.
②烧水或做饭时,人不要远离灶具.如果火焰熄灭而又没有及时关闭燃气灶,可燃性气体会在厨房里扩散,遇明火会发生_____的危险.