题目内容
【题目】氨气是重要的化工原料。
资料1:氨气是一种有刺激性气味,密度小于空气,极易溶于水的气体。
资料2:氨气能使湿润的红色石蕊试纸变蓝色。
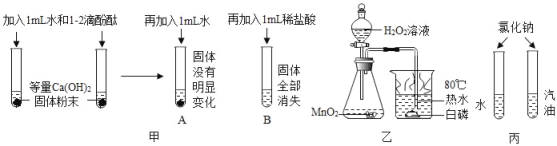
资料3:实验室制备氨气的方法:①浓氨水滴入生石灰中;
②熟石灰和氯化铵固体混合加热。
探究一 气体制备
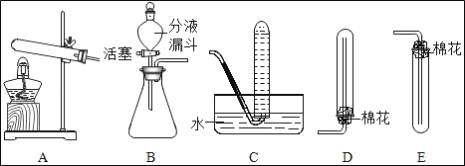
(1)若采用资料3中方法①制取氨气,发生装置可选用图1中_____装置(填序号),收集氨气选用_____装置(填序号),检验试管中已集满氨气的方法是_____。
(2)若采用资料3中方法②来制取氨气,其发生装置若用来制取氧气,写出制取氧气反应的化学方程式_____。
探究二 氨气测定
(3)实验室常用稀硫酸来吸收氨气(NH3),生成硫酸铵[(NH4)2SO4],写出该反应的化学方程式:_____。
(4)用上述原理和图2实验装置测定某公厕中氨气含量平均值。
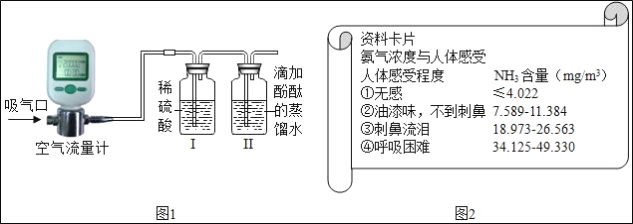
经过较长时间不间断的测定共吸取2m3的空气,最后称得Ⅰ装置增重了40mg。该公厕空气属于人体感受_____(填序号) 程度。某同学认为测得结果与自身感受不相符,请你分析产生这一误差的可能原因:_____。
探究三 氨气用途
研究人员发现氨气还可用来制作新型燃料电池,其制作工艺流程如图3。
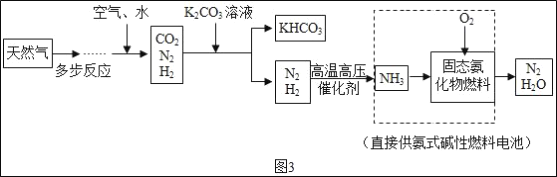
(5)该流程中可重复利用的物质是_____(写一种)。
(6)步骤①加入K2CO3溶液的作用是除去CO2,写出该反应的化学方程式_____。
(7)从环保角度看,直接供氨式碱性燃料电池的优点有_____。
【答案】B D 把湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝色,指明氨气已满 2KClO3![]() 2KCl+3O2↑ 2NH3+H2SO4=(NH4)2SO4 ③ 吸收空气的时间比较长等(合理即可) 氮气 CO2+H2O+K2CO3=2KHCO3 生成物是氮气和水,无污染
2KCl+3O2↑ 2NH3+H2SO4=(NH4)2SO4 ③ 吸收空气的时间比较长等(合理即可) 氮气 CO2+H2O+K2CO3=2KHCO3 生成物是氮气和水,无污染
【解析】
氨气是一种有刺激性气味,密度小于空气,极易溶于水的气体,能使湿润的红色石蕊试纸变蓝色,氨气是碱性气体,实验室制备氨气的方法:①浓氨水滴入生石灰中;②熟石灰和氯化铵固体混合加热。若采用资料3中方法①浓氨水滴入生石灰中制取氨气,发生装置可选用图1中B;氨气的密度小于空气,极易溶于水的气体,因此只能用向下排空气法收集;检验试管中已集满氨气的方法是:把湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝色,指明氨气已满;实验室常用稀硫酸来吸收氨气(NH3),生成硫酸铵[(NH4)2SO4], 若采用资料3中方法②来制取氨气,其发生装置若用来制取氧气,装置A中的试管口没有棉花团,因此是加热氯酸钾制氧气,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气。
(1)若采用资料3中方法①浓氨水滴入生石灰中制取氨气,发生装置可选用图1中B;氨气的密度小于空气,极易溶于水的气体,因此只能用向下排空气法收集;检验试管中已集满氨气的方法是:把湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝色,指明氨气已满。
(2)若采用资料3中方法②来制取氨气,其发生装置若用来制取氧气,装置A中的试管口没有棉花团,因此是加热氯酸钾制氧气,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,化学方程式为 ![]() 。
。
(3)实验室常用稀硫酸来吸收氨气(NH3),生成硫酸铵[(NH4)2SO4],故答案为:2NH3+H2SO4=(NH4)2SO4。
(4)经过较长时间不间断的测定共吸取2m3的空气,最后称得Ⅰ装置增重了40mg。该公厕空气属于人体感受③,因为40mg÷2m3=20mg/m3;某同学认为测得结果与自身感受不相符,产生这一误差的可能原因:吸收空气的时间比较长等。
(5)探究三中,该流程中可重复利用的物质是氮气;故答案为:氮气;
(6)步骤①加入K2CO3溶液的作用是除去CO2,二氧化碳和水和碳酸钾反应生成碳酸氢钾,化学方程式为:CO2+H2O+K2CO3=2KHCO3。
(7)从环保角度看,直接供氨式碱性燃料电池的优点有:生成物是氮气和水,无污染。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用“盐酸﹣硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH溶液吸收H2S制取Na2S(硫化钠又称臭碱、臭苏打、黄碱),其中反应的化学方程式为:H2S+2NaOH=Na2S+2H2O
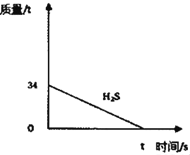
(1)若某化工厂每天要处理34吨H2S,需消耗氢氧化钠溶液中的溶质NaOH多少吨_____?(写出计算过程)
(2)如图已经画出处理34吨H2S的质量变化曲线,请在图中画出生成物Na2S质量的变化曲线,并在纵坐标上标明相应的质量_____。
(3)表中是回收H2S工艺的各项生产成本:
项目 | 单价(万元/吨) |
NaOH | 0.25 |
Na2S | 0.5 |
辅助费用(以处理1吨H2S计) | 0.12 |
工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理34吨H2S的方法能盈利_____万元。