题目内容
【题目】利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。某同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如图2所示。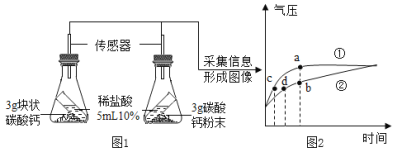
(1)图1中发生反应的化学方程式是________________。
(2)图2中②表示的是________(填“块状”或“粉末状”)碳酸钙与盐酸的反应
(3)反应后产生的气体的总质量①____②(填“>”<”或“=”)
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 块状 =
【解析】
(1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)与等溶质质量分数的稀盐酸反应时,碳酸钙与盐酸的接触面积越大,反应速率越快,由图象可知,曲线②表示块状碳酸钙和稀盐酸反应;
(3)由图可知,碳酸钙粉末产生的CO2等于块状碳酸钙产生的CO2.故填:等于。

【题目】下表为某食品包装袋的部分说明。请回答下列问题:
商品名称 | XX饼干 |
配料 | 小麦粉、植物油、鲜鸡蛋、食盐、膨松剂、食用香精等 |
规格 | 500g |
储存方法 | 存放于阴凉干燥处、避免阳光直射 |
保质期 | 270天 |
(1)配料中加入鸡蛋,有多个方面的作用。它可以改善饼干的口感并使饼干有一定的柔韧性等,从营养的角度看,鸡蛋的作用是______。
(2)配料中可用于腌制蔬菜的物质是______。
(3)小麦粉中富含淀粉,其化学式可表示为(C6H10O5)n,则6.48克淀粉在人体内经过一系列的变化最终转化为水和______克二氧化碳。
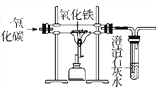
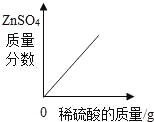
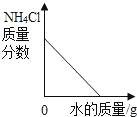
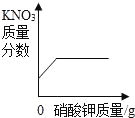
【题目】下列图象与所述实验相符的是( )
A | B | C | D |
向一定量锌粒中加入过量稀硫酸 | 向一定量氯化铵饱和溶液中不断加入水 | t℃时,向一定量不饱和的硝酸钾溶液中不断加入硝酸钾晶体 | 向一定量氢氧化钠和氢氧化钡的混合溶液中加入稀硫酸 |
|
|
|
|
A. AB. BC. CD. D
【题目】用“盐酸﹣硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH溶液吸收H2S制取Na2S(硫化钠又称臭碱、臭苏打、黄碱),其中反应的化学方程式为:H2S+2NaOH=Na2S+2H2O
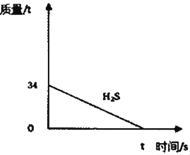
(1)若某化工厂每天要处理34吨H2S,需消耗氢氧化钠溶液中的溶质NaOH多少吨_____?(写出计算过程)
(2)如图已经画出处理34吨H2S的质量变化曲线,请在图中画出生成物Na2S质量的变化曲线,并在纵坐标上标明相应的质量_____。
(3)表中是回收H2S工艺的各项生产成本:
项目 | 单价(万元/吨) |
NaOH | 0.25 |
Na2S | 0.5 |
辅助费用(以处理1吨H2S计) | 0.12 |
工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理34吨H2S的方法能盈利_____万元。