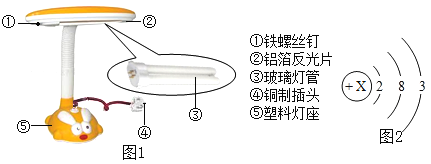
题目内容
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息井对相关问题进行研究。生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1。将产物分离得晶体A, 并使A其充分受热,可分解制得纯碱。
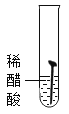
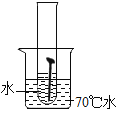
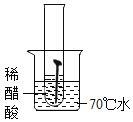
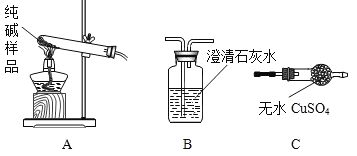
(1)设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下面装置中选择):
选择的装置 | 实验现象 | 实验结论 |
__________ | __________ | 样品不含晶体A |
(2)另取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为_______________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(3)同学们为了测定该纯碱样品的纯度,设计了如下实验:
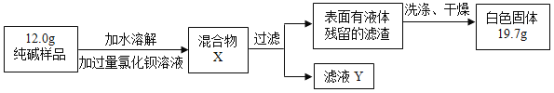
①加入过量的氯化钡溶液目的是___________________。
②判断滤渣是否洗干净,可向最后的洗出液中滴加________,然后观察现象判断。
A氯化钡溶液 B稀硫酸 C稀盐酸 D碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为__________。(精确到0. 1 % )
【答案】AB或AC B中不变浑浊或C中不变蓝 ![]() 将溶液中的碳酸钠全部转化为碳酸钡沉淀 BD 88.3%
将溶液中的碳酸钠全部转化为碳酸钡沉淀 BD 88.3%
【解析】
(1)晶体A为![]() ,加热
,加热![]() 分解生成
分解生成![]() 、
、![]() 和
和![]() ,可以选择AB装置,若样品不含晶体A,实验现象是B中不变浑浊,也可以选择AC装置,若样品不含晶体A,实验现象是C中不变蓝,实验设计如下表所示:
,可以选择AB装置,若样品不含晶体A,实验现象是B中不变浑浊,也可以选择AC装置,若样品不含晶体A,实验现象是C中不变蓝,实验设计如下表所示:
选择的装置 | 实验现象 | 实验结论 |
AB或AC | B中不变浑浊或C中不变蓝 | 样品不含晶体A |
(2)另取纯碱样品加水溶解,向该溶液中加入过量稀硝酸,再滴加硝酸银溶液,有白色沉淀,由于加入的稀硝酸过量,故白色沉淀为氯化银,样品中含有氯化钠,硝酸银和氯化钠反应生成白色沉淀氯化银和硝酸钠,产生沉淀的方程式为:![]() ;
;
组成探究三:
(3)①加入过量的氯化钡溶液目的是将溶液中的碳酸钠全部转化为碳酸钡沉淀;
②氯化钡和稀硫酸反应生成白色沉淀硫酸钡和盐酸,和碳酸钾反应生成白色沉淀碳酸钡和氯化钾,因此判断滤渣是否洗干净,可向最后的洗出液中滴加稀硫酸或碳酸钾溶液,然后观察现象判断,故填:BD;
③生成碳酸钡沉淀的质量为19.7g,设碳酸钠质量为x,则
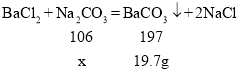
![]()
样品中碳酸钠的质量分数为:![]() 。
。
故填:88.3%。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究。
(实验一)取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验。
实验图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
(1)通过上述实验可知,温度越高铁钉生锈速率越_____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快。
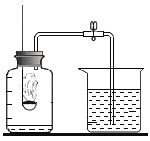
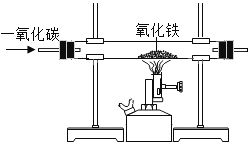
(实验二)为探究铁锈的成分,用下图所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
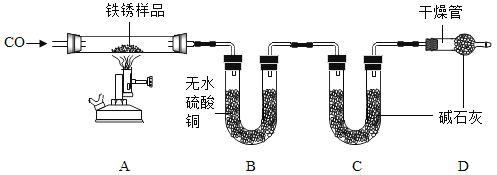
(查阅资料)①无水硫酸铜能吸收水而变蓝,
②碱石灰成分为氢氧化钠和氧化钙,既能吸收水也能吸收CO2。
(2)请指出该实验装置的一个缺陷:_____。
(3)A中加热前,先通入CO一段时间,目的是_____。
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有_____元素,从而推断出空气中的_____参加了铁生锈反应。
(实验记录)
铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
反应前 | 23.2 | 232.4 | 198.2 |
充分反应后 | 11.2 | 239.6 | 211.4 |
根据上表数据推算,可确定铁锈的成分,用FexOynH2O表示,则n=_____。
(5)若缺少D装置,x:y的值_____(填“偏大”、“偏小”或“无影响”)。
(实验三)小组同学将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。

(6)回答下列问题:
①ab段发生反应的化学方程式是_____。
②bc段发生反应的化学方程式是_____。
③cd段压强变化的主要原因是_____。
【题目】资源、能源与环境已成为人们日益关注的问题。
(1)化石燃料包括_____、石油和天然气,天然气主要成分充分燃烧的化学方程式是_____。
(2)二氧化硫、一氧化碳是大气污染物。请写出它们的化学式并标出各元素的化合价_____、_____。
(3)下列实验中,对应的现象以及结论都正确的是_____。
选项 | A | B | C | D |
实验 |
|
|
|
|
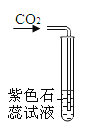
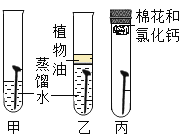
现象 | 红磷熄灭冷却后,打开弹簧夹,水倒流入集气瓶,约占集气瓶容积的1/5 | 石蕊变红 | 黑色粉末变成红色 | 甲中铁钉生锈,乙、丙中铁钉无明显变化 |
结论 | 氧气约占空气质量的1/5 | 二氧化碳具有酸性 | 一氧化碳具有还原性 | 铁生锈需要与水和氧气同时接触 |