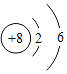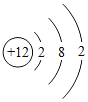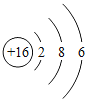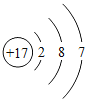题目内容
【题目】资源、能源与环境已成为人们日益关注的问题。
(1)化石燃料包括_____、石油和天然气,天然气主要成分充分燃烧的化学方程式是_____。
(2)二氧化硫、一氧化碳是大气污染物。请写出它们的化学式并标出各元素的化合价_____、_____。
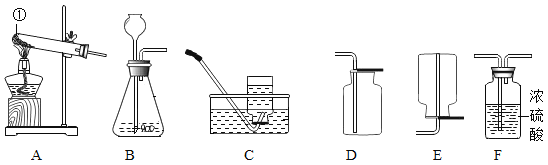
(3)下列实验中,对应的现象以及结论都正确的是_____。
选项 | A | B | C | D |
实验 |
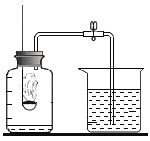
|
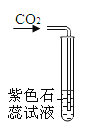
|
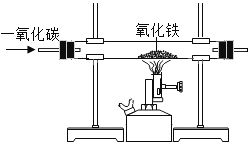
|
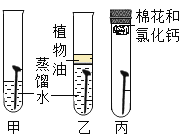
|
现象 | 红磷熄灭冷却后,打开弹簧夹,水倒流入集气瓶,约占集气瓶容积的1/5 | 石蕊变红 | 黑色粉末变成红色 | 甲中铁钉生锈,乙、丙中铁钉无明显变化 |
结论 | 氧气约占空气质量的1/5 | 二氧化碳具有酸性 | 一氧化碳具有还原性 | 铁生锈需要与水和氧气同时接触 |
【答案】煤 CH4+2O2![]() CO2+2H2O
CO2+2H2O ![]()
![]() D
D
【解析】
(1)化石燃料包括煤、石油和天然气,天然气的成分是甲烷,甲烷燃烧生成二氧化碳和水,故填:煤;CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)二氧化硫中硫元素为+4价,氧元素为-2价,一氧化碳中碳元素为+2价,氧元素为-2价,故填:![]() ;
;![]() ;
;
(3)A、红磷熄灭冷却后,打开弹簧夹,水倒流入集气瓶,约占集气瓶容积的1/5,说明氧气占空气体积的五分之一,不是质量,错误;
B、石蕊变红,不能说明二氧化碳有酸性,因为此反应中有水参与,错误;
C、氧化铁是红色的,生成的铁粉是黑色的,错误;
D、甲中铁钉与水和氧气同时接触生锈,乙中铁钉只与水接触不生锈,丙中铁钉只与氧气接触不生锈,说明铁生锈需要与水和氧气同时接触,正确;
故填:D。

【题目】某校化学兴趣小组参观制碱厂后,获得以下信息井对相关问题进行研究。生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1。将产物分离得晶体A, 并使A其充分受热,可分解制得纯碱。
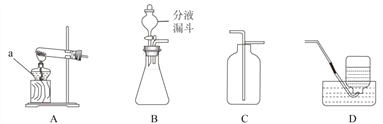
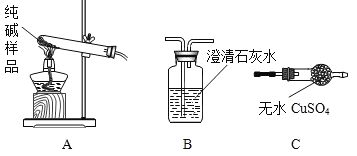
(1)设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下面装置中选择):
选择的装置 | 实验现象 | 实验结论 |
__________ | __________ | 样品不含晶体A |
(2)另取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为_______________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(3)同学们为了测定该纯碱样品的纯度,设计了如下实验:
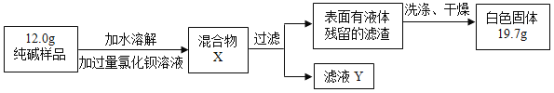
①加入过量的氯化钡溶液目的是___________________。
②判断滤渣是否洗干净,可向最后的洗出液中滴加________,然后观察现象判断。
A氯化钡溶液 B稀硫酸 C稀盐酸 D碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为__________。(精确到0. 1 % )
【题目】化学是在分子、原子水平上研究物质的组成、结构、性质及其变化规津的一门基础自然科学,回答下列问题:
(1)在二氧化碳、铁和氢氧化钠三种物质中,氢氧化钠由_____构成;(写具体粒子的名称)。
(2)下表列出了部分元素的原子结构示意图。回答下列问题:
O | Mg | S | Cl |
|
|
|
|
硫原子在化学反应中容易_____(填“得到”或“失去”)电子,氧元素和硫元素化学性质具有相似性的原因是它们原子的_____相同。
(3)下列对生活中的现象用分子相关知识解释不正确的是_____。
A室内插花,满室飘香,说明分子不断地运动
B水沸腾时,掀起壶盖,说明分子的大小随温度升高而增大
C10mL酒精和l0mL水混合后,体积小于20mL,说明分子之间有间隔
D湿衣服放在火炉旁,干得较快,说明分子运动速率随温度升高而增大
(4)在化学变化前后一定发生改变的是_____(填字母)。
A元素的种类 B原子的个数 C原子的质量 D分子的种类
(5)氟元素和氢元素形成的化合物的水溶液叫氢氟酸(HF),可用于雕刻玻璃,其主要原因是氢氟酸和玻璃的主要成分二氧化硅发生反应,生成四氟化硅气体和水,写出该反应的化学方程式_____。