题目内容
【题目】甲、乙、丙、丁4种常见物质,是由氢、碳、氧、钠、钙元素中的一种或几种组成。
(1)甲是一种由分子构成的单质,其中每个甲分子中含有两个原子,其化学式可能是_____________(填一种即可)。
(2)乙俗称纯碱或苏打,其化学式为_____________。
(3)丙是一种氧化物,遇水放出大量的热,可以在食品包装中作干燥剂。丙的化学式是_______。
(4)丁物质是雪碧汽水中含有的一种酸,其化学式为______________。
【答案】![]()
![]()
![]()
![]()
【解析】
(1)由提供的元素组成的氢气和氧气,都是由分子构成的单质,其中每个分子中含有两个原子,其化学式为![]() 或
或![]() ;故填:
;故填:![]() ;
;
(2)碳酸钠俗称苏打或纯碱;故填:![]() ;
;
(3)由提供的元素组成的氧化钙是一种金属氧化物,能与水反应并放出大量的热,可用于食品包装中作干燥剂;故填:![]() ;
;
(4)汽水中含有的酸是碳酸;故填:![]() 。
。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案【题目】为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,以下说法成立的是 ( )
反应前 | 反应后 |
| ||
A | B | C | D | |
|
|
|
| |
A.物质C是由离子构成B.以上4种物质中属于氧化物的是A和C
C.反应中C,D两种物质的质量比是1︰2D.该反应属于置换反应
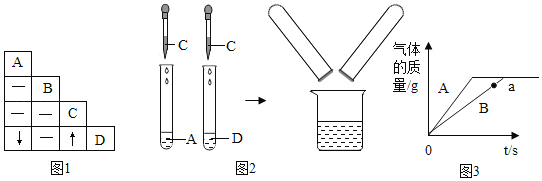
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息井对相关问题进行研究。生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1。将产物分离得晶体A, 并使A其充分受热,可分解制得纯碱。
(1)设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下面装置中选择):
选择的装置 | 实验现象 | 实验结论 |
__________ | __________ | 样品不含晶体A |
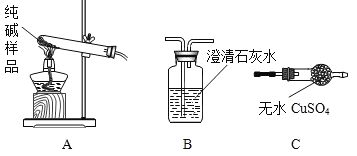
(2)另取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为_______________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(3)同学们为了测定该纯碱样品的纯度,设计了如下实验:
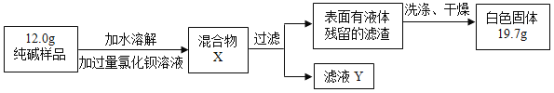
①加入过量的氯化钡溶液目的是___________________。
②判断滤渣是否洗干净,可向最后的洗出液中滴加________,然后观察现象判断。
A氯化钡溶液 B稀硫酸 C稀盐酸 D碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为__________。(精确到0. 1 % )
【题目】如图为采用“数字化”实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某溶液,纵坐标y表示烧杯中的某个量。下列对物质X与纵坐标y的分析正确的是

选项 | 物质X | 纵坐标y |
A | 水 | 溶液的质量 |
B | 水 | 溶液的pH |
C | 氢氧化钠溶液 | 溶质的质量 |
D | 氢氧化钙溶液 | 溶液中钙元素质量 |
A. AB. BC. CD. D