题目内容
【题目】酸、碱、盐都是重要的化合物,请回答下列有关问题。
(1)简述怎样稀释浓硫酸________。
(2)家中的暖水瓶使用一段时间后,有一层厚厚的水垢,下列最适宜用来除去暖水瓶中水垢的是________。
A 食盐水 B 稀硫酸 C 食醋 D 小苏打
(3)酸还可以用于金属除锈,写出用稀硫酸除铁锈的化学方程式________。
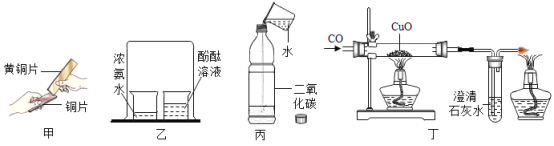
(4)实验室选用以下装置制取纯净、干燥的![]() ,并验证其部分性质。
,并验证其部分性质。
①B装置中发生反应的化学方程式为_____________。
②C装置中浓硫酸的作用是________。
③请在D中简要补画出![]() 的收集装置图________。
的收集装置图________。
④要证明在E装置中![]() 与NaOH溶液发生了反应,应选用的试剂是________。
与NaOH溶液发生了反应,应选用的试剂是________。
(5)某化学兴趣小组同学欲测定其配制的氯化钠溶液的溶质质量分数。取100g所配制氯化钠溶液,加入足量的硝酸银溶液,生成沉淀经洗涤、干燥后称量为14.35g,试计算该氯化钠溶液的溶质质量分数________。
【答案】将浓硫酸沿容器内壁缓缓注入水中,并用玻璃棒不断搅拌 C ![]()
![]() 吸收水分,干燥气体
吸收水分,干燥气体 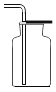
![]() 溶液等(合理即可) 5.85%(过程见解析)
溶液等(合理即可) 5.85%(过程见解析)
【解析】
(1)浓硫酸稀释的方法为:将浓硫酸沿容器内壁缓缓注入水中,并用玻璃棒不断搅拌;
(2)水垢的主要成分是碳酸钙、碳酸镁等物质,可以用稀酸反应除去,稀硫酸和食醋都是酸性物质,食醋是日常生活中家用物品最常见的酸性物质,是最适宜的选择,因此除去暖水瓶中水垢可以利用食醋,C选项正确,符合题意,故选C;
(3)稀硫酸除铁锈,硫酸与氧化铁反应生成硫酸铁和水,反应的化学方程式为
![]() ;
;
(4)A装置为二氧化碳的发生装置,B装置饱和碳酸氢钠溶液除去杂质氯化氢气体,C装置浓硫酸除去水蒸气,则有:
①B装置中,碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳和水,除去氯化氢杂质,发生反应的化学方程式为![]() 。
。
②C装置中浓硫酸的作用是吸收水分,干燥气体。
③由于二氧化碳的密度比空气密度大,要得到干燥的二氧化碳气体,应该采用向上排空气法,D中![]() 的收集装置图为
的收集装置图为 。
。
④![]() 与NaOH溶液反应生成碳酸钠和水,要证明在E装置中
与NaOH溶液反应生成碳酸钠和水,要证明在E装置中![]() 与NaOH溶液发生了反应,即证明E装置溶液中有碳酸钠,应选用的试剂是氯化钙溶液,若加入氯化钙溶液,有白色沉淀产生,说明有碳酸钠。
与NaOH溶液发生了反应,即证明E装置溶液中有碳酸钠,应选用的试剂是氯化钙溶液,若加入氯化钙溶液,有白色沉淀产生,说明有碳酸钠。
(5)设该氯化钠溶液中氯化钠的质量为x,则有:
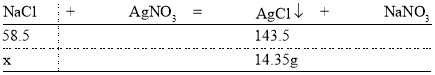
由![]()
解得x=5.85g
100g所配制氯化钠溶液中溶质质量分数为![]()
答:氯化钠溶液的溶质质量分数为5.85%。

【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想Ⅰ:不相等; 猜想Ⅱ:相等;
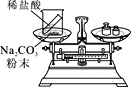
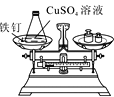
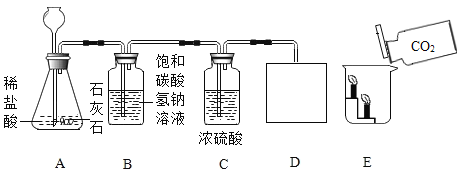
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲 组 | 乙 组 | |
实验方案 (反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转 |
结论 | 猜想Ⅰ正确 | 猜想Ⅱ正确 |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在____中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是_____(填序
号),从另外两种装置中任选一种指出其不足__________。
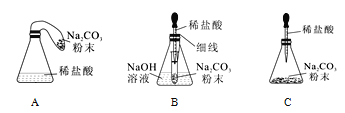
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(解释应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_______种元素组成。