题目内容
【题目】根据课本实验回答下列问题:
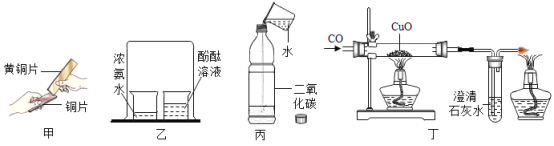
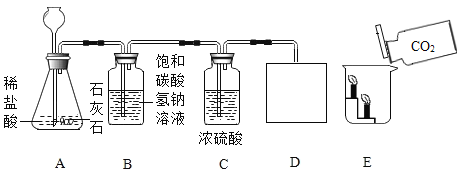
(1)甲实验中________的表面会划出痕迹;
(2)乙实验的主要目的是_____________;
(3)写出丙实验中发生反应的化学方程式_______________;
(4)丁实验可以说明CO具有的化学性质有___________;
【答案】铜片 验证分子是不断运动的 CO2+H2O=H2CO3 还原性、可燃性
【解析】
:(1)合金的硬度比组成它的各成分的硬度大,故黄铜片能在铜片上刻画出痕迹;
(2)乙实验中烧杯中酚酞试液变红,可以说明分子是不停运动的,也说明氨水呈碱性,酚酞试液遇碱性物质变红;
(3)二氧化碳与水反应生成碳酸,反应的化学方程式为:CO2+H2O=H2CO3;
(4)实验中硬质玻璃管中黑色粉末变红色,是一氧化碳和氧化铜反应,生成铜,可以得出的结论是一氧化碳具有还原性;因为一氧化碳具有可燃性,酒精灯的作用是将多余的一氧化碳燃烧掉,以防止污染空气。
故答案为:
(1)铜片;
(2)验证分子是不停运动的;
(3)CO2+H2O=H2CO3;
(4)还原性、可燃性。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
物质 | K2CO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 11.1 | 6.34 |
(1)KMnO4中锰元素的化合价为_____.
(2)操作I的名称是_____.“干燥”过程中温度不宜过高的原因是_____(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3;不用稀H2SO4酸化,反应的化学方程式为:3K2 MNO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+2H2O;工业上不采用稀H2SO4酸化的原因是_____.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:2K2 MnO4+2H2O![]() 2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.
2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.
【题目】水是宝贵的自然资源,我们要认识它,爱护它。
(1)水是由______组成的,电解水的化学方程式是________
(2)硬水不利于我们的生活,生活中我们可以用____的方法将其软化
(3)请推荐你在生活中节约用水的一个好举措______
(4)自然界的水因含有多种杂质而不能直接饮用。需要经过自来水厂处理后才能饮用。目前很多自来水厂用氯气进行消毒。消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:

若D的化学式为HClO,写出图甲所示反应的化学方程式 。小军将新制的氯气通入紫色石蕊试液中,惊奇地发现试液先变红,接着就褪色了。他查阅资料得知新制的氯水具有漂白性。为探究溶液褪色的原因,他设计了几个实验:
(实验准备)用紫色石蕊试液浸泡几朵小纸花,并晾干;加热少量新制的氯水,冷却后灌入喷壶。
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | 实验Ⅴ |
|
|
|
|
|
(实验现象)①实验Ⅰ:_______________________ ②实验Ⅱ、Ⅲ:紫花不变色
③实验Ⅳ:紫花先变红后褪色 ④实验Ⅴ:紫花变红,不褪色
(实验结论)新制氯水中具有漂白性的物质是______________(写化学式)。