题目内容
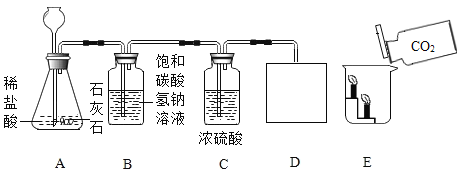
【题目】实验室部分仪器或装置如下图所示,请回答下列问题。
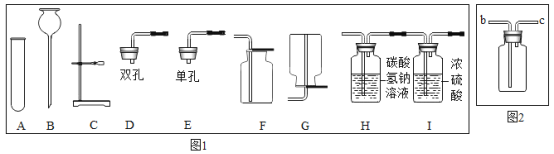
(1)写出仪器B的名称____________。
(2)实验室以氯酸钾为原料制取并收集氧气,完成这个实验图1中还缺少的仪器是_______,反应的化学方程式为____________。若用图2的装置收集氧气,氧气从_______导管口通入(填“b”或“c”),验满的方法__________。
(3)在实验室制取并收集一瓶纯净干燥的二氧化碳,请从图1中选择合适的仪器组装,装置组合为____和H(填编号),反应的化学方程式为________________ , 该反应的基本反应类型_________。其中H装置中碳酸氢钠溶液的作用是__________________。
(4)为了证明氢氧化钙溶液与稀盐酸能发生反应,氢氧化钠溶液与二氧化碳也能发生反应。如图所示进行实验(装置气密性良好,实验前活塞和弹簧夹K处于关闭状态)。

实验一:氢氧化钙溶液与稀盐酸发生反应
打开分液漏斗的活塞,使稀盐酸逐滴滴加入A中锥形瓶,观察到___________的现象时,关闭活塞,证明氢氧化钙溶液与稀盐酸发生反应;
实验二:氢氧化钠与二氧化碳反应
将注射器中的氢氧化钠溶液推入B中锥形瓶,过一段时间后,打开弹簧夹K,观察到_________的现象并且溶液呈红色,证明氢氧化钠溶液与二氧化碳确实发生了反应。请写出二氧化碳与氢氧化钠溶液反应的化学方程式是_____________。锥形瓶B中溶液最后呈红色_________(填“能”或“不能”)证明氢氧化钠有剩余。
【答案】长颈漏斗 酒精灯 2KClO3![]() 2KCl+3O2↑ b 把带火星的木条放在c导管口,木条复燃,证明氧气满了 ABCDF CaCO3+2HCl=CaCl2+H2O+CO2↑ 复分解反应 吸收并除去氯化氢气体 溶液由红色变无色 A中液体倒流入B,B中生成白色沉淀 CO2+2NaOH=Na2CO3+H2O 不能
2KCl+3O2↑ b 把带火星的木条放在c导管口,木条复燃,证明氧气满了 ABCDF CaCO3+2HCl=CaCl2+H2O+CO2↑ 复分解反应 吸收并除去氯化氢气体 溶液由红色变无色 A中液体倒流入B,B中生成白色沉淀 CO2+2NaOH=Na2CO3+H2O 不能
【解析】
(1)长颈漏斗方便加液体药品,故答案为:长颈漏斗;
(2)实验室以氯酸钾为原料制取并收集氧气,完成这个实验图1中还缺少的仪器是:酒精灯;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;若用图2的装置收集氧气,氧气从长管进入,因为氧气的密度比空气大;验满的方法是:把带火星的木条放在c导管口,木条复燃,证明氧气满了;故答案为:酒精灯;2KClO3![]() 2KCl+3O2↑;b;把带火星的木条放在c导管口,木条复燃,证明氧气满了;
2KCl+3O2↑;b;把带火星的木条放在c导管口,木条复燃,证明氧气满了;
(3)在实验室制取并收集一瓶纯净干燥的二氧化碳,请从图1中选择合适的仪器组装,装置组合为:ABCDF;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,属于复分解反应;其中H装置中碳酸氢钠溶液的作用是:吸收并除去氯化氢气体;故答案为:ABCDF;CaCO3+2HCl=CaCl2+H2O+CO2↑;复分解反应;吸收并除去氯化氢气体;
(4)实验一:打开分液漏斗的活塞,使稀盐酸逐滴滴加入A中锥形瓶,观察到溶液由红色变无色的现象时,关闭活塞,证明氢氧化钙溶液与稀盐酸发生反应;
实验二:将注射器中的氢氧化钠溶液推入B中锥形瓶,过一段时间后,打开弹簧夹K,观察到:A中液体倒流入B,B中生成白色沉淀的现象并且溶液呈红色,证明氢氧化钠溶液与二氧化碳确实发生了反应;二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,配平即可;锥形瓶B中溶液最后呈红色不能证明氢氧化钠有剩余,因为碳酸钠溶液显碱性;
故答案为:溶液由红色变无色;A中液体倒流如B,B中生成白色沉淀;CO2+2NaOH=Na2CO3+H2O;不能。

【题目】水是宝贵的自然资源,我们要认识它,爱护它。
(1)水是由______组成的,电解水的化学方程式是________
(2)硬水不利于我们的生活,生活中我们可以用____的方法将其软化
(3)请推荐你在生活中节约用水的一个好举措______
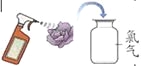
(4)自然界的水因含有多种杂质而不能直接饮用。需要经过自来水厂处理后才能饮用。目前很多自来水厂用氯气进行消毒。消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:

若D的化学式为HClO,写出图甲所示反应的化学方程式 。小军将新制的氯气通入紫色石蕊试液中,惊奇地发现试液先变红,接着就褪色了。他查阅资料得知新制的氯水具有漂白性。为探究溶液褪色的原因,他设计了几个实验:
(实验准备)用紫色石蕊试液浸泡几朵小纸花,并晾干;加热少量新制的氯水,冷却后灌入喷壶。
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | 实验Ⅴ |
|
|
|
|
|
(实验现象)①实验Ⅰ:_______________________ ②实验Ⅱ、Ⅲ:紫花不变色
③实验Ⅳ:紫花先变红后褪色 ④实验Ⅴ:紫花变红,不褪色
(实验结论)新制氯水中具有漂白性的物质是______________(写化学式)。
【题目】化学是一门以实验为基础的科学。
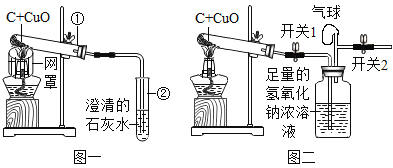
(1)化学课堂上,老师做了如图一的实验(网罩的作用是_____)。随着不断加热,试管①里逐渐有红色固体产生,化学方程式为_____,该反应的基本反应类型属于_____。同时试管②里的现象是_____。
(2)小明发现通入试管②里的气体有逸出液面的现象,怀疑试管①里还有其它气体生成,比如一氧化碳。老师首先赞扬小明有科学的质疑精神,建议在化学兴趣小组的活动中展开探究。请你也参与其中,一起探究。
(提出问题)碳还原氧化铜的反应还有一氧化碳生成吗?
(猜想与假设)猜想一:没有一氧化碳生成;猜想二:还有一氧化碳生成
(设计方案)在老师的帮助下,小明设计出如图二实验。为了提高实验效果,小明加大了反应物的用量。老师提示:实验前应先验纯,再将两个开关都打开,再加热,反复挤压气球,将其中的气体排尽,老师这样提示的目的是_____。
(进行实验)
实验操作 | 实验现象 | 实验结论 |
先按老师的提示操作,加热一会儿后,关闭开关2.待充分反应,关闭开关1,停止加热。 | 黑色粉末变成红色_____ | 逸出液面的气体不是二氧化碳 |
_____ | 气体被点燃 | 逸出液面的气体是一氧化碳。猜想二成立。 |
(交流与提高)同学们通过对以上实验的讨论与分析,认为一氧化碳的产生至少源自两个反应:
一是试管内反应物直接反应生成;二是生成物又发生反应而生成。请你写出其中一个化学方程式_____。
实验中生成的二氧化碳被氢氧化钠浓溶液吸收没有明显现象,同学们想进一步检验该反应的生成物,可选用的药品有_____(填序号)。
①酚酞溶液 ②氢氧化钙溶液 ③稀盐酸 ④锌粒 ⑤氯化钙溶液
某同学在做碳还原氧化铜的实验时,碳粉将8g氧化铜完全还原后收集到的气体质量总和为2.4g,则此时生成的气体为_____。
(评价与反思)经过本次活动,同学们感到,正是因为小明具有质疑精神,我们这次活动才有了更多、更新的收获。同时也认为图一装置不够完善,为了防止尾气对空气的污染,应该把上图装置中的右部分装置换成下列_____装置(填字母序号)。