题目内容
【题目】某校同学们开展金属化学性质的实验探究活动。
(1)某同学设计不同实验方案,验证铁和铜两种金属活动性
实验步骤 | 实验现象 | 实验结论 |
①分别取等量的铁片和铜片于两试管中,加入等量的稀硫酸 | ________ | 铁比铜活动性强 |
②________ | ________ |
(2)某小组做镁与稀硫酸反应实验时,发现该反应很剧烈,还观察到试管内产生“白雾”,即对“白雾”进行如下探究:反应过程中,“白雾” 产生的原因是________________________。写出镁与稀硫酸反应的化学方程式____________________。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是____________________。
[提出问题]实验过程中,大家只听见氢气燃烧的爆鸣声而没有看见火焰,小组讨论如何实现氢气持续地燃烧并看见淡蓝色火焰呢?
[查阅资料]水蒸的存在,对氢气燃烧火焰的传播有很明显的阻滞作用,即水蒸气浓度越高,火焰传播的速度越慢。
[设计实验]经老师指导,同学们将实验进行了改进,如图所示。
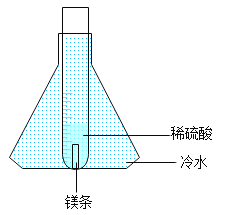
[实验操作]取0.3 g镁条放入装有5.0 g稀硫酸的试管中,将试管放入盛有冷水的锥形瓶中,反应开始后,用燃着的木条点燃试管口的氢气,观察到氢气持续燃烧,火焰呈现淡蓝色。
[解释与反思]①锥形瓶中冷水的作用是__________。
②在实验冷却恢复室温的过程中,同学们还发现镁条消失一段时间后试管内部产生了白色晶体。对此“意外”的现象,你的解释是________。请计算此时溶液中溶质的质量分数为________(列出计算式即可)。(室温下硫酸镁的溶解度为33.5 g)
【答案】铁片的表面有气泡产生,铜片的表面无气泡产生 取打磨过的铁片放入适量的硫酸铜溶液中 观察到铁片表面有红色物质析出 镁和稀硫酸反应放热,使试管内水汽化成水蒸汽,其遇冷后冷凝成小水珠( 或水汽化后的水蒸气冷凝/液化成小水珠等合理答案均可) ![]() 试管并未密闭,是敞口的,不会爆炸。(或并不是在密闭、有限的空间或试管是敞口的等合理答案均可) 降温,使试管中的水蒸气冷凝(或使水蒸气转化为小水珠或降低试管中水蒸气的浓度等合理答案均可) 一段时间后,温度降低,硫酸镁溶解度降低,所以析出白色晶体
试管并未密闭,是敞口的,不会爆炸。(或并不是在密闭、有限的空间或试管是敞口的等合理答案均可) 降温,使试管中的水蒸气冷凝(或使水蒸气转化为小水珠或降低试管中水蒸气的浓度等合理答案均可) 一段时间后,温度降低,硫酸镁溶解度降低,所以析出白色晶体 ![]()
【解析】
根据实验现象,铁与稀硫酸反应有气泡产生,而铜没有明显现象,说明铁位于H前,铜位于H后,故铁的活动性比铜强;还可以设计金属与另一种金属盐溶液反应,观察是否发生反应来判断金属的活动性;故有:
实验步骤 | 实验现象 | 实验结论 |
①分别取等量的铁片和铜片于两试管中,加入等量的稀硫酸 | 铁片的表面有气泡产生,铜片的表面无气泡产生 | 铁比铜活动性强 |
②取打磨过的铁片放人适量的硫酸铜溶液中 | 观察到铁片表面有红色物质析出 |
(2)镁与稀硫酸反应时,反应很剧烈,还观察到试管内产生“白雾”,反应过程中,“白雾” 产生的原因是:镁和稀硫酸反应放热,使试管内水汽化成水蒸汽,其遇冷后冷凝成小水珠(或水汽化后的水蒸气冷凝/液化成小水珠等合理答案均可)。镁与稀硫酸反应生成硫酸镁和氢气,反应的化学方程式为![]() 。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是:试管并未密闭,是敞口的,不会爆炸。(或并不是在密闭、有限的空间或试管是敞口的等合理答案均可)。
。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是:试管并未密闭,是敞口的,不会爆炸。(或并不是在密闭、有限的空间或试管是敞口的等合理答案均可)。
[解释与反思]:
①锥形瓶中冷水的作用是:降温,使试管中的水蒸气冷凝(或使水蒸气转化为小水珠或降低试管中水蒸气的浓度等合理答案均可)。
②在实验冷却恢复室温的过程中,发现镁条消失一段时间后试管内部产生了白色晶体,解释是:一段时间后,温度降低,硫酸镁溶解度降低,所以析出白色晶体。室温下硫酸镁的溶解度为33.5 g,此时溶液中溶质的质量分数为![]() 。
。

【题目】根据下表中三种化肥的信息,回答有关问题。
名称 | 尿素 | 硝酸铵 | 碳酸氢铵 |
化学式 | CO(NH2)2 | NH4NO3 | NH4HCO3 |
市场价格 | 1080元/吨 | 810元/吨 | 330元/吨 |
(1)碳酸氢铵的相对分子质量为_____。
(2)硝酸铵中氮元素的质量分数为_____。
(3)纯净的尿素中碳元素与氢元素的质量比为_____。
(4)分别用10000元采购尿素、硝酸铵、碳酸氢铵三种化肥,所购得的化肥中氮元素的质量分别为x、y、z,则x、y、z之间的关系是x_____y_____z(用>、=或<表示)。