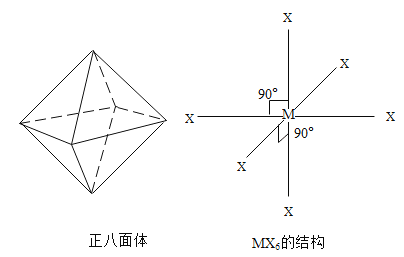
题目内容
【题目】实验室有一包食盐,已经过初步提纯,除去了难溶性杂质,但仍含有CaSO4、MgSO4、CaCl2、MgCl2杂质。现取该食盐样品20.000g,测得其中含有Ca、Mg两种元素共0.300g,S元素0.064g(其他杂质忽略不计)。
(1)该食盐中CaSO4与MgSO4的物质的量之和为mol。
(2)计算该食盐中NaCl的质量分数的范围。
【答案】0.002;93.60%<该食盐中NaCl的质量分数<95.13%
【解析】
(1)硫元素的物质的量=0.064g÷32g/mol=0.002mol,由化学式可知,CaSO4、MgSO4的物质的量都与其中的硫元素的物质的量相同,所以该食盐中CaSO4与MgSO4的物质的量之和等于硫元素的物质的量,故填0.002。
(2)如果杂质硫酸盐中只有硫酸镁,则镁元素的质量=24g/mol×0.002mol=0.048g,则钙元素的质量=0.300g0.048g=0.252g,其物质的量=0.252g÷40g/mol=0.0063mol,则氯化钙的质量=111g/mol×0.0063mol=0.699g,硫酸镁的质量=120g/mol×0.002mol=0.24g,样品中氯化钠的质量=20g0.699g0.24g=19.06g,该食盐中NaCl的质量分数=![]() ×100%≈95.13%;
×100%≈95.13%;
如果杂质硫酸盐中只有硫酸钙,则钙元素的质量=40g/mol×0.002mol=0.08g,则镁元素的质量=0.300g0.08g=0.22g,其物质的量=0.252g÷24g/mol=0.0105mol,则氯化镁的质量=95g/mol×0.0105mol=0.9975g,硫酸钙的质量=136g/mol×0.002mol=0.272g,样品中氯化钠的质量=20g0.9975g0.272g=18.7505g,该食盐中NaCl的质量分数=![]() ×100%≈93.60%,s所以93.60%<该食盐中NaCl的质量分数<95.13%,故填93.60%<该食盐中NaCl的质量分数<95.13%。
×100%≈93.60%,s所以93.60%<该食盐中NaCl的质量分数<95.13%,故填93.60%<该食盐中NaCl的质量分数<95.13%。

【题目】某校同学们开展金属化学性质的实验探究活动。
(1)某同学设计不同实验方案,验证铁和铜两种金属活动性
实验步骤 | 实验现象 | 实验结论 |
①分别取等量的铁片和铜片于两试管中,加入等量的稀硫酸 | ________ | 铁比铜活动性强 |
②________ | ________ |
(2)某小组做镁与稀硫酸反应实验时,发现该反应很剧烈,还观察到试管内产生“白雾”,即对“白雾”进行如下探究:反应过程中,“白雾” 产生的原因是________________________。写出镁与稀硫酸反应的化学方程式____________________。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是____________________。
[提出问题]实验过程中,大家只听见氢气燃烧的爆鸣声而没有看见火焰,小组讨论如何实现氢气持续地燃烧并看见淡蓝色火焰呢?
[查阅资料]水蒸的存在,对氢气燃烧火焰的传播有很明显的阻滞作用,即水蒸气浓度越高,火焰传播的速度越慢。
[设计实验]经老师指导,同学们将实验进行了改进,如图所示。
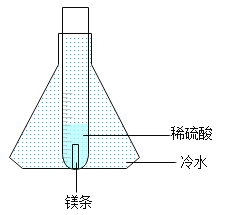
[实验操作]取0.3 g镁条放入装有5.0 g稀硫酸的试管中,将试管放入盛有冷水的锥形瓶中,反应开始后,用燃着的木条点燃试管口的氢气,观察到氢气持续燃烧,火焰呈现淡蓝色。
[解释与反思]①锥形瓶中冷水的作用是__________。
②在实验冷却恢复室温的过程中,同学们还发现镁条消失一段时间后试管内部产生了白色晶体。对此“意外”的现象,你的解释是________。请计算此时溶液中溶质的质量分数为________(列出计算式即可)。(室温下硫酸镁的溶解度为33.5 g)
【题目】某课外兴趣小组的同学对二氧化碳的制取和性质进行相关探究。
(实验回顾)(1)实验室用大理石与稀盐酸制取二氧化碳的化学方程式为_______________。
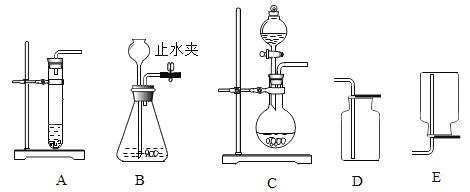
(2)下图可用于实验室制取CO2发生装置的是__________(填字母)。
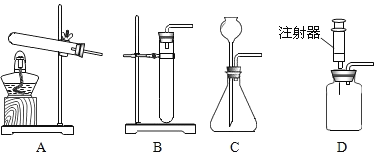
(实验探究)CO2与NaOH溶液反应
(查阅资料)
(1)过量CO2通入NaOH溶液,发生两步反应。
第一步:____________________________(用化学方程式表示)
第二步:Na2CO3+H2O+CO2=2NaHCO3
(2)Na2CO3和NaHCO3部分溶解度表
温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
NaHCO3/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
Na2CO3/g | 7.1 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
(实验设计)在室温为15℃时,将10gNaOH固体完全溶解于80g水中,而后匀速通入CO2,同时用传感器测定溶液的pH变化,结果如图1所示。多次重复实验,所得实验结果基本一致。
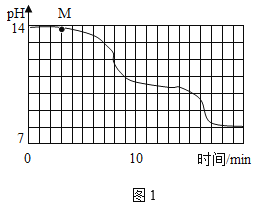
(1)通过图像分析,NaHCO3溶液显_____(填“酸性”、“中性”或“碱性”)。
(2)为了确定M点溶液的成分,同学们进行如下实验:
实验步骤 | 实验现象 | 初步实验结论 |
①取样,滴加过量的BaCl2溶液 | 产生白色沉淀 | 含有Na2CO3、NaOH |
②在①反应后的上层清液中滴加____ | _____ |
(3)实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时溶液中可观察到的现象是______________________________。
(拓展延伸)某同学向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的稀盐酸,测得消耗盐酸与生成CO2的质量之间关系如图2、图3所示。(忽略CO2在水中的溶解)
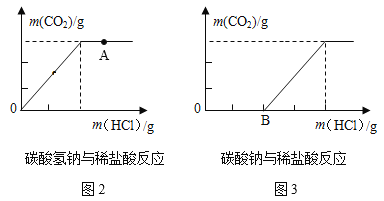
(1)图2中A点溶液中的溶质是_________(写化学式 ),图3中从B点开始的变化关系与图2完全重合,图3中B点溶液中的溶质是__________(写化学式)。
(2)写出OB段发生反应的化学方程式______________________________。
【题目】工业上冶炼金属锌主要有火法和湿法两种工艺。
(1)火法炼锌时发生如下反应:
2ZnS+3O2 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2 2CO;ZnO+CO
2CO;ZnO+CO Zn+CO2。
Zn+CO2。
①化合物ZnS中Zn元素的化合价是_____,上述反应在鼓风炉中控制温度在1100℃至1300℃进行,使生成的锌气化蒸馏出来,蒸馏过程属于_____变化。
②已知反应前矿石中ZnS的质量为ag,则理论上可以生成Zn的质量为_____g(用含a的式子表示,可不化简)。
(2)湿法炼锌的原理是利用CO32-与Zn2+结合生成ZnCO3沉淀。某研究小组利用该原理,用碳酸钠作为沉淀剂,探究从含锌废水中回收锌的最佳条件,实验的数据如下:
实验编号 | 初步处理的废液用量/mL | pH值 | 反应时间/min | 沉锌率% |
a | 800 | 6 | 30 | 84.30 |
b | 800 | 7.5 | 10 | 85.27 |
c | 800 | 7.5 | 30 | 99.60 |
d | 800 | 8.0 | 30 | 99.55 |
①本实验探究了哪些因素对沉锌率的影响_____。
②已知碳酸钠溶液呈碱性。实验中碳酸钠使用量最大的是_____(填编号)。工业生产中采用实验_____(填编号)的提取条件更合理。
【题目】补全实验方案。请从A ~ C中任选二个作答,若均作答,按前二个计分。
序号 | 目的 | 操作 | 现象 | 结论 |
A | 验证温度对KNO3溶解度的影响 |
均加入_____KNO3固体 已知:20 ℃和40 ℃时,KNO3溶解度分别为31.6 g和63.9 g 装有红墨水 的毛细管 | 20℃时固体部分溶解,40℃时固体全部溶解 | KNO3的溶解度随温度的升高而增大 |
B | 研究NH4NO3和NaOH溶解时的温度变化 |
| __________ | NH4NO3溶解时温度降低;NaOH 溶解时温度升高 |
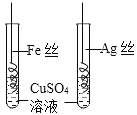
C | 比较Fe、Cu和Ag的金属活动性顺序 |
| Fe丝表面有红色固体析出,Ag丝表面无明显现象 | __________ |