题目内容
【题目】水是重要的自然资源,在生产生活中有重要用途。
(1)自然界中的水含有较多杂质,净化过程中加入活性炭,是利用其_______性。
(2)生活中将硬水软化的方法有____________。
(3)生活中油污常用洗洁精除去,此时洗洁精所起的作用是___________________。
(4)有一种家用环保型消毒液发生器,其中发生的第一步反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2), 该反应的化学方程式为___________________。
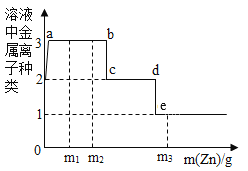
(5)溶液配制时,水常作溶剂,请根据下图回答:

①t1°C时,将等质量的甲和乙两种固体物质分别在100 g水中充分溶解后,如上左所示,一定形成饱和溶液的是_____ (填 “烧杯1”或“烧杯2”),保持温度不变,要使剩余的固体继续溶解可采用的方法是______。
②如上右图中a、b分别表示甲、乙两种物质的溶解度曲线,则乙的曲线是_________(填“a”或“b”)。
③下列叙述正确的是_______。
A 甲的溶解度比乙大
B 将等质量的甲、乙饱和溶液从t3°C降到t2°C,析出晶体的质量甲较大
C 将t3°C时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D t2°C时,甲、乙溶液的溶质质量分数一定相等
【答案】吸附性 加热煮沸 乳化作用  烧杯1 加足量的水 b B
烧杯1 加足量的水 b B
【解析】
(1)活性炭具有具有吸附性,能除去异味、色素等;
(2)日常生活中可以通过加热煮沸的方法降低水的硬度;
(3)洗洁精中含有乳化剂,乳化剂具有乳化功能,可以去除油污;
(4)根据题意,氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2), 故化学方程式表示如下: ![]() ;
;
(5)①由图6可知,甲在烧杯1中不能再溶解了,可判断烧杯1中的溶液一定是饱和溶液,在保持t1°C不变的情况下,要使剩余的固体继续溶解可采用的方法是加足量的水;
②由在t1°C时等量的水中溶解溶质的情况可知,b的溶解度较大,所以,乙的曲线是b;
③A 要比较溶解度的大小,必须指明温度,此选项错误;
B 由图7溶解度曲线可知,甲对应的是a曲线,乙对应的是b曲线,a的溶解度受温度影响较大,将等质量的甲、乙饱和溶液,从t3°C降到t2°C,析出晶体的质量甲较大,此选项正确;
C 由于甲的溶解度随温度的升高而增大。所以,将t3°C时甲的饱和溶液变为不饱和溶液,可采取升温的方法,此选项错误;
D 由图7溶解度曲线可知,在t2°C时a、b曲线交于一点,此时的溶解度相同,但题目未指明甲和乙的溶液是否是饱和状态,所以其溶质的质量分数不一定相等,此选项错误。故选B。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】某校同学们开展金属化学性质的实验探究活动。
(1)某同学设计不同实验方案,验证铁和铜两种金属活动性
实验步骤 | 实验现象 | 实验结论 |
①分别取等量的铁片和铜片于两试管中,加入等量的稀硫酸 | ________ | 铁比铜活动性强 |
②________ | ________ |
(2)某小组做镁与稀硫酸反应实验时,发现该反应很剧烈,还观察到试管内产生“白雾”,即对“白雾”进行如下探究:反应过程中,“白雾” 产生的原因是________________________。写出镁与稀硫酸反应的化学方程式____________________。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是____________________。
[提出问题]实验过程中,大家只听见氢气燃烧的爆鸣声而没有看见火焰,小组讨论如何实现氢气持续地燃烧并看见淡蓝色火焰呢?
[查阅资料]水蒸的存在,对氢气燃烧火焰的传播有很明显的阻滞作用,即水蒸气浓度越高,火焰传播的速度越慢。
[设计实验]经老师指导,同学们将实验进行了改进,如图所示。
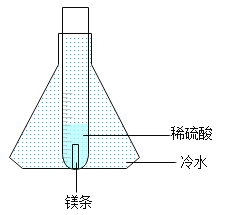
[实验操作]取0.3 g镁条放入装有5.0 g稀硫酸的试管中,将试管放入盛有冷水的锥形瓶中,反应开始后,用燃着的木条点燃试管口的氢气,观察到氢气持续燃烧,火焰呈现淡蓝色。
[解释与反思]①锥形瓶中冷水的作用是__________。
②在实验冷却恢复室温的过程中,同学们还发现镁条消失一段时间后试管内部产生了白色晶体。对此“意外”的现象,你的解释是________。请计算此时溶液中溶质的质量分数为________(列出计算式即可)。(室温下硫酸镁的溶解度为33.5 g)