题目内容
【题目】食盐是一种重要的化工原料。请回答下列问题。
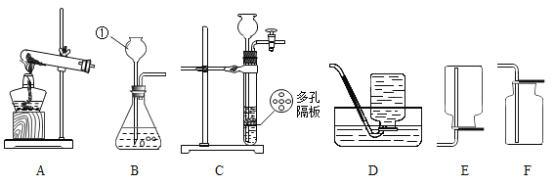
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作I所用的玻璃仪器有:烧杯、玻璃棒和_______。
②在蒸发过程中,待_________时,停止加热,利用余热将滤液蒸干。
(2)为了除去NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如下图所示的实验:

回答下列问题:
①实验I中加入试剂A除去的杂质是_______;
②实验Ⅱ中加入的试剂B是________溶液;
③滤液②中除Na+和Cl-外,还含有的离子是_______(填离子符号);
④实验Ⅲ中发生的中和反应的化学方程式为_________
【答案】漏斗 有较多量固体析出 MgCl2和Na2SO4 Na2CO3 OH- 、CO32- ![]()
【解析】
(1)①操作I是过滤,所用的玻璃仪器有:烧杯、玻璃棒和漏斗。②在蒸发过程中,待有较多量固体析出时,停止加热,利用余热将滤液蒸干。
(2)①实验I中加入的试剂A是Ba(OH)2溶液,除去的杂质是MgCl2和Na2SO4;②实验Ⅱ中加入的试剂B是Na2CO3溶液,以除去过量的Ba(OH)2及CaCl2。③滤液②中含有生成的NaOH、过量的Na2CO3、原来含有的NaCl,故滤液中的离子除Na+和Cl-外,还含有的离子是OH- 、CO32。④中和反应是酸碱之间的反应,故实验Ⅲ中发生的中和反应的化学方程式为:![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校同学们开展金属化学性质的实验探究活动。
(1)某同学设计不同实验方案,验证铁和铜两种金属活动性
实验步骤 | 实验现象 | 实验结论 |
①分别取等量的铁片和铜片于两试管中,加入等量的稀硫酸 | ________ | 铁比铜活动性强 |
②________ | ________ |
(2)某小组做镁与稀硫酸反应实验时,发现该反应很剧烈,还观察到试管内产生“白雾”,即对“白雾”进行如下探究:反应过程中,“白雾” 产生的原因是________________________。写出镁与稀硫酸反应的化学方程式____________________。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是____________________。
[提出问题]实验过程中,大家只听见氢气燃烧的爆鸣声而没有看见火焰,小组讨论如何实现氢气持续地燃烧并看见淡蓝色火焰呢?
[查阅资料]水蒸的存在,对氢气燃烧火焰的传播有很明显的阻滞作用,即水蒸气浓度越高,火焰传播的速度越慢。
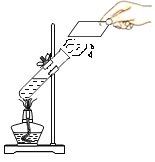
[设计实验]经老师指导,同学们将实验进行了改进,如图所示。
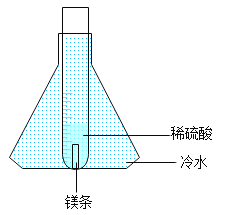
[实验操作]取0.3 g镁条放入装有5.0 g稀硫酸的试管中,将试管放入盛有冷水的锥形瓶中,反应开始后,用燃着的木条点燃试管口的氢气,观察到氢气持续燃烧,火焰呈现淡蓝色。
[解释与反思]①锥形瓶中冷水的作用是__________。
②在实验冷却恢复室温的过程中,同学们还发现镁条消失一段时间后试管内部产生了白色晶体。对此“意外”的现象,你的解释是________。请计算此时溶液中溶质的质量分数为________(列出计算式即可)。(室温下硫酸镁的溶解度为33.5 g)
【题目】下列实验方案与实验结论相对应的是( )
选项 | ① | ② | ③ | ④ |
方案 |
|
|
|
|
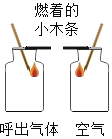
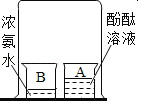
现象 | 装有呼出气体的集气瓶中的小木条熄灭,装有空气的集气瓶中的小木条无明显变化 | A烧杯中的酚酞试液变红,B烧杯中的浓氨水无明显变化 | 玻璃片上有小水珠出现 | 蜡烛产生的白烟被火柴点燃,使蜡烛重新燃烧 |
结论 | 呼出气体中的二氧化碳含量比空气中的多 | 氨分子在不断运动,而酚酞分子不运动 | 液态水和气态水可以相互转化 | 白烟的成分不是二氧化碳 |
A.①②B.②③C.③④D.①④