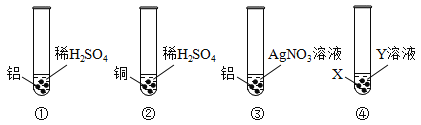
题目内容
【题目】某化学兴趣小组的同学想从含有硫酸铝、硫酸铜的废液中回收金属铜,设计流程如下:
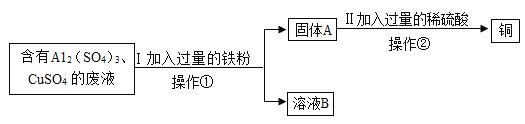
(1)操作1的名称为_________
(2)Ⅰ中加入铁粉不是铁块,其目的是___,Ⅱ中有关反应的化学方程式______。
(3)Ⅱ中加入过量的稀硫酸的目的是_____________。
【答案】过滤 增大接触面积,并使硫酸铜完全反应 ![]() 除去剩余的铁粉得到铜
除去剩余的铁粉得到铜
【解析】
(1)操作①是将固液分离,名称为过滤。
(2)Ⅰ中加入铁粉不是铁块,其目的是增大接触面积,并使硫酸铜完全反应,Ⅱ中剩余的铁粉与稀硫酸反应生成硫酸亚铁和氢气,有关反应的化学方程式为![]() 。
。
(3)固体A中含有剩余的铁和生成的铜,需要得到铜,Ⅱ中加入过量的稀硫酸的目的是除去剩余的铁粉得到铜。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】绿矾(FeSO4·7H2O)用途广泛,可用作净水剂,医学上可用作补血剂,还可用于制颜料。
(1)绿矾是一种絮凝剂,利用其溶于水后生成的胶状物对杂质的吸附作用,使杂质沉降来达到净水的目的。
(2)缺铁会引起贫血,铁是一种人体必需的微量元素。
(3)《本草纲目》中记载,绿矾“煅过变赤,则为绛矾”。绛矾是古代壁画、彩塑中使用的一种红色颜料。
(4)铁的氧化物中已知三氧化二铁为红色。四氧化三铁和氧化亚铁为黑色。
(5)氢氧化钠溶液可以吸收二氧化硫和三氧化硫;高锰酸钾溶液可以检验二氧化硫。
某化学兴趣小组同学对绿矾高温分解的产物很感兴趣,进行了如下探究。
(查阅资料)①绿矾高温分解的产物是一种固态金属氧化物和几种气态非金属氧化物。
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
③无水硫酸铜遇水变蓝。④硫有两种常见的氧化物,部分性质如下表:
硫的氧化物 | 熔点 | 沸点 | 能否使高锰酸钾溶液褪色 |
SO2 | -75.5℃ | -10℃ | 能 |
SO3 | 16.8℃ | 44.8℃ | 不能 |
(提出问题)《本草纲目》中记载绿矾“煅过变赤”,经实验验证绿矾高温分解确实产生红色固体,说明绿矾高温分解产生的一种固态金属氧化物是____________,那么产生的几种气态非金属氧化物是什么呢?
(进行猜想)猜想1:H2O和_____________;
猜想2:H2O和SO3;
猜想3:H2O、SO2和SO3
甲同学认为无需通过进一步实验即可判定猜想2错误,理由是__________________________。
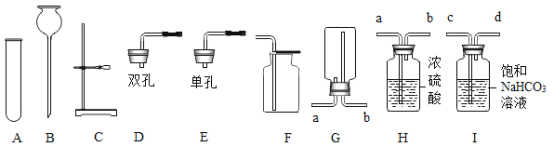
(设计实验)乙同学用以下装置检验绿矾高温分解产生的气态非金属氧化物:
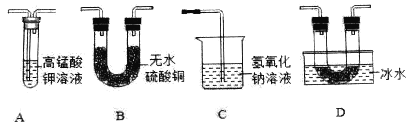
需将绿矾高温分解产生的气体依次通过_____________(填字母,且每套装置限用一次)。
(分析现象)进行上述实验,观察到A中试管内溶液_________,B中U形管内固体__________,D中U形管内出现无色晶体,说明猜想3正确。绿矾高温分解的化学方程式为______________。