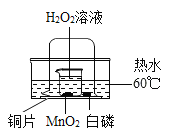
题目内容
【题目】下列图示实验所得出的结论中,正确的是()
A. 氧气的占空气质量的1/5
氧气的占空气质量的1/5
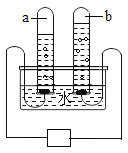
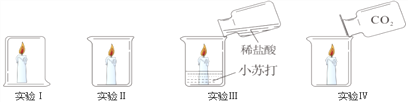
B.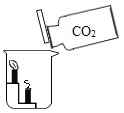 CO2的密度比空气大、不支持燃烧、不能燃烧
CO2的密度比空气大、不支持燃烧、不能燃烧
C.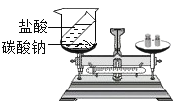 天平不平衡说明该反应不遵守质量守恒定律
天平不平衡说明该反应不遵守质量守恒定律
D.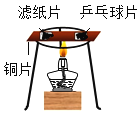 燃烧条件之一是需要可燃物
燃烧条件之一是需要可燃物
【答案】B
【解析】
A、红磷燃烧消耗瓶中的氧气,生成白色固体五氧化二磷,瓶中气压减小,使得内外产生气压差,冷却后,打开止水夹,水进入集气瓶中约五分之一体积,从而得到氧气约占空气体积的五分之一,不符合题意;
B、下面的蜡烛先熄灭,上面的蜡烛后熄灭,证明二氧化碳既不燃烧、也不支持燃烧,且密度比空气大,符合题意;
C、盐酸和碳酸钠反应生成的二氧化碳气体逸散到空气中,因此天平不平衡,但该反应时化学变化,遵守质量守恒定律,不符合题意;
D、乒乓球片和滤纸片都是可燃物,都与氧气接触,同时加热,而乒乓球片先燃烧,滤纸片后燃烧,因此得出燃烧的条件之一是温度需达到可燃物的着火点,不符合题意。故选B。

【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)
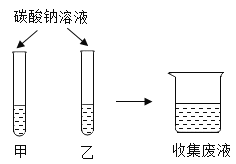
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为:_______。
(2)为处理实验废液,小组同学对废液成分进行探究:
(提出问题)假设二氧化碳全部逸出,废液中的溶质是什么?
(分析)小涛认为一定有氯化钠时,其依据是________。
(猜想)可能有HC1、Na2CO3、CaCl2中的一种或两种。
(设计实验)(本环节可供选择的试剂有稀盐酸、碳酸钠溶液、氯化钙溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | ______ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | 取烧杯中溶液样品,滴加足量的_____溶液 | _______ | 溶液中含有CaCl2 |
(结论)废液中的溶质是HCl、NaCl、CaCl2。
(反思)小梅认为根据步骤①的现象,步骤②可以省略,原因是_________;
(应用)若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰,石灰石三种物质中,应该选择_________。