题目内容
【题目】硫化氢(H2S)是一种密度比空气密度大的气体,实验室通常用固体硫化亚铁(FeS)和稀硫酸混合,常温下通过发生复分解反应制得硫化氢气体。试回答:
(1)实验室制取硫化氢气体的化学方程式为______________________。
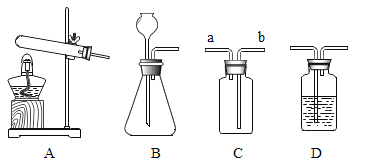
(2)根据装置图回答下列问题。
①制得硫化氢气体的发生装置可以选用___________(填序号)。该装置在实验室还可以用来制取氧气,写出用该装置制取氧气的化学方程式_____________________。
②若用C装置收集硫化氢气体,进气口应为__________(填“a”或“b”)。
【答案】![]() B
B 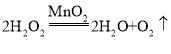 b
b
【解析】
(1)实验室通常用固体硫化亚铁(FeS)和稀硫酸混合,常温下通过发生复分解反应制得硫化氢气体,复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,故另一种产物是硫酸亚铁,该反应的化学方程式为:![]() ;
;
(2)①实验室通常用固体硫化亚铁(FeS)和稀硫酸混合,常温下通过发生复分解反应制得硫化氢气体,该反应属于固液不加热反应,发生装置应选B;
该装置适用于过氧化氢和二氧化锰制取氧气,过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为: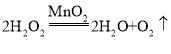 ;
;
②硫化氢(H2S)是一种密度比空气密度大的气体,故若用C装置收集硫化氢气体,进气口应为b。

【题目】某兴趣小组发现,上周做实验用的氢氧化钠固体忘记了盖瓶盖,他们欲对该固体的变质情况进行探究。
(提出问题)该瓶氢氧化钠固体是否变质,变质情况如何?
(查阅资料)①碳酸钠溶液的pH最大约为10.6,饱和的碳酸氢钠溶液约为8.0,氯化钙溶液呈中性。
②NaOH、Na2CO3分别在水和酒精中的溶解度如下表所示:
物质种类 | NaOH | Na2CO3 | |||
温度 | 20℃ | 40℃ | 20℃ | 40℃ | |
溶剂 | 水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 | |
(作出猜想)猜想Ⅰ:固体未变质;
猜想Ⅱ:固体部分变质;
猜想Ⅲ:固体全部变质。
(实验探究)(1)兴趣小组同学取少量样品于烧杯中,加适量水溶解,测得溶液的pH约为12。由此他们得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是______。
(2)组内其他同学取步骤(1)烧杯中少量溶液于试管中,加入过量的____溶液,振荡,有白色沉淀生成;不再产生沉淀时,取上层清液于另一支试管中,滴加____,溶液变红。
(实验结论)通过实验,兴趣小组证明猜想__正确。
(反思评价)根据查阅资料,有同学提出可以通过氢氧化钠和碳酸钠在酒精中溶解度不同来验证猜想Ⅲ正确。请你帮助他设计实验方案:_____。
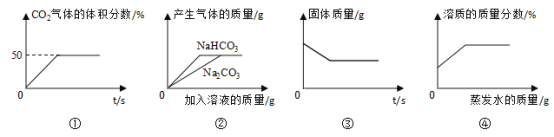
(实验拓展)实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取一定量样品,溶于水配成250.0mL溶液将pH=1的稀盐酸逐滴加入体积为25.0mL的该溶液中,所得曲线如图所示:
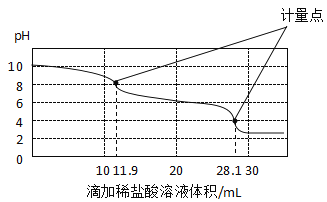
a.上一个计量点前发生反应的化学方程式为_____。
b.下一个计量点时溶液中大量存在的阴离子是_______。
【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为:_______。
(2)为处理实验废液,小组同学对废液成分进行探究:
(提出问题)假设二氧化碳全部逸出,废液中的溶质是什么?
(分析)小涛认为一定有氯化钠时,其依据是________。
(猜想)可能有HC1、Na2CO3、CaCl2中的一种或两种。
(设计实验)(本环节可供选择的试剂有稀盐酸、碳酸钠溶液、氯化钙溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | ______ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | 取烧杯中溶液样品,滴加足量的_____溶液 | _______ | 溶液中含有CaCl2 |
(结论)废液中的溶质是HCl、NaCl、CaCl2。
(反思)小梅认为根据步骤①的现象,步骤②可以省略,原因是_________;
(应用)若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰,石灰石三种物质中,应该选择_________。
【题目】(2018徐州节选)为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:________________________。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气; 猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
(查阅资料)(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
(2)H2+CuO![]() Cu+H2O
Cu+H2O
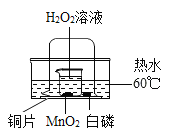
(实验探究)师生设计了如图装置进行实验(部分仪器省略),请完成下列表格。

主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是______________ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显显现 | 猜想________正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | / | / |
④冷却,将A中液体用水稀释 | A中液体变为______色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是__________________________________。
(2)请完成铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+________。
CuSO4+SO2↑+________。
(反思拓展)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是______________________。