题目内容
【题目】品味馒头中的化学
山西是面食的王国。发面馒头是山西人餐桌上不可缺少的一道美食。制作馒头的面粉是由小麦经筛选清洗后研磨而成的,其主要成分是淀粉(C6H10O5)n )。
制作馒头首先要发面,过去,人们用“老面”当“起子”,让面团发酵,由于“老面”中同时含有乳酸菌,乳酸菌在发酵过程中会产生有酸味的乳酸,加入适量的碱面可除去酸味,使馒头酥松多孔。乳酸具有酸的通性。有时候,人们也用小苏打作发酵粉,小苏打受热易分解生成碳酸钠、水和二氧化碳,使用时可在小苏打中加入一定量的食酷,这样蒸出的馒头不仅暄软,而且碱味还不大。
现在人们大多用酵母菌发酵,当面团中缺乏氧气时,酵母茵通过将葡萄糖转化成为二氧化碳和乙醇来获取能量,化学方程式为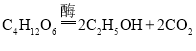 ,产生的二氧化碳将面团发起,而酒精则挥发。在有氧气的环境中,在酶的催化作用下,酵母菌将葡萄糖转化为水和二氧化碳、酵母菌最适宜生长的温度范围是20-~30°C,温度达到60°C时酵母菌死亡。酵母细胞中含有碳、氢、氧、磷、钙、铁、铜、锌、钴等元素。
,产生的二氧化碳将面团发起,而酒精则挥发。在有氧气的环境中,在酶的催化作用下,酵母菌将葡萄糖转化为水和二氧化碳、酵母菌最适宜生长的温度范围是20-~30°C,温度达到60°C时酵母菌死亡。酵母细胞中含有碳、氢、氧、磷、钙、铁、铜、锌、钴等元素。
我们在吃馒头时,少量的淀粉在咀嚼过程中被口腔中的淀粉酶催化,从而发生水解反应,生成麦芽糖(C12H22O11), 大部分的淀粉和麦芽糖进入小肠后,被彻底消化为能被人体吸收的葡萄糖。
小麦中含有较为丰富的B族维生素,B族维生素在酸性溶液中很稳定,即使加热也不会分解。而在碱性环境中很容易被分解破坏,即使温度不是太高也是如此。B族维生素还怕高温,怕漂白粉、氯气、二氧化硫和双氧水等物质,而且还容易在淘米、洗淀粉的过程中溶在水里流失掉。B族维生素有助您保持旺盛的精力和昂扬的情绪。
根据短文回答问题:
(1)向“老面”发好的面团中加入碱面,发生反应的微观实质是____________。
(2)用小苏打做发酵粉,蒸出的馒头暄软多孔的原因是____________________。
(3)用酵母菌发酵时,应将面团放在____________的环境中,酵母菌有氧呼吸时发生反应的化学方程式是_____________。写出酵母菌中含有的人体必需的一种微量元素____________。
(4)下列说法正确的是_______________。
A 人体摄人淀粉后主要在胃里被消化
B 用酵母菌发酵制作馒头时,不需要加碱面
C 二氧化硫漂白馒头,不会影响健康
D 长期食用加入大量碱面的馒头,人体会缺乏B族维生素
【答案】碳酸根离子和氢离子反应生成水分子和二氧化碳分子 小苏打受热分解生成二氧化碳气体或小苏打受热分解生成的碳酸钠能与食醋反应生成二氧化碳或小苏打能与食醋反应生成二氧化碳(都写出或写一点) 温暖(或20~30°C) 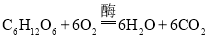 铁、铜、锌、钴中的任一种,写名称或元素符号均可 B、D
铁、铜、锌、钴中的任一种,写名称或元素符号均可 B、D
【解析】
(1)向“老面”发好的面团中加入碱面,发生反应的微观实质是:碳酸根离子和氢离子反应生成水分子和二氧化碳分子;
(2)用小苏打做发酵粉,蒸出的馒头暄软多孔的原因是:小苏打受热分解生成二氧化碳气体或小苏打受热分解生成的碳酸钠能与食醋反应生成二氧化碳或小苏打能与食醋反应生成二氧化碳;
(3)酵母菌最适宜生长的温度范围是20~30°C,故用酵母菌发酵时,应将面团放在20~30℃的环境中;
在有氧气的环境中,在酶的催化作用下,酵母菌将葡萄糖转化为水和二氧化碳,该反应的化学方程式为: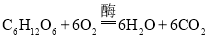 ;
;
酵母细胞中含有碳、氢、氧、磷、钙、铁、铜、锌、钴等元素,含有人体必需的微量元素有铁、钴、锌、铜等。
(4)A、由资料可知,大部分的淀粉和麦芽糖进入小肠后,被彻底消化为能被人体吸收的葡萄糖,不符合题意;
B、用酵母菌发酵制作馒头时,不含乳酸菌,不需要加碱面,符合题意;
C、二氧化硫对人体有害,不能用来漂白馒头,不符合题意;
D、由资料可知,B族维生素在酸性溶液中很稳定,即使加热也不会分解。而在碱性环境中很容易被分解破坏,故长期食用加入大量碱面的馒头,人体会缺乏B族维生素,符合题意。故选BD。

 阅读快车系列答案
阅读快车系列答案【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
【题目】老师带领同学们探究铝和稀盐酸、稀硫酸的反应时发现:铝和稀盐酸剧烈反应,而和稀硫酸几乎不反应。
写出铝和稀盐酸反应的化学方程式_____。
[提出问题]铝和稀硫酸为什么几乎不反应?
[猜想与假设]猜想1:稀盐酸和稀硫酸中的氢离子浓度不同;
猜想2:盐酸中的氯离子对反应起了促进作用;
猜想3:硫酸中的硫酸根离子对反应起了阻碍作用。
[进行实验]
实验序号 | 实验操作 | 实验现象 | 实验结论 |
① | _____ | _____ | 猜想1错误 |
② | 在两支试管中各加入5 mL氢离子浓度相等的稀硫酸,分别插入规格相同的打磨的铝丝。 向其中一支试管中加入1g NaCl晶体 | _____ | 猜想2正确; 猜想3错误 |
[实验反思]
有同学用浓盐酸代替氯化钠证明猜想2正确,他的错误之处是_____。
[实验解释]老师带领同学们利用数字化手持技术探究金属铝和稀盐酸反应时容器内压强和温度随时间变化的关系(如图)。
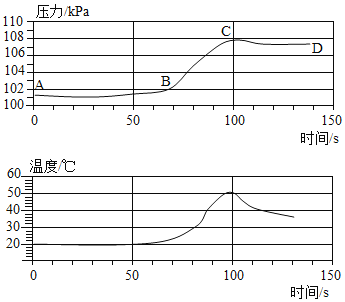
由图可知,_____(填字母序号)点时铝和稀盐酸反应完全。
(1) 0~50s内AB段压强变化不明显,原因可能是_____。
(2) BC段压强明显上升的主要原因是_____。
(3) CD段压强下降的原因是_____。
【题目】化学学习小组进行“铝和酸溶液反应的探究”的活动。用铝片分别和氢离子浓度相同的稀盐酸、稀硫酸反应,发现铝片和稀盐酸反应现象非常明显,而和稀硫酸却几乎不反应。
(提出问题)是什么原因导致两者的差异?
两种酸中氢离子浓度相同,那么存在的差异就可能跟H+所处的环境不同有关(如阴离子的不同)。
(作出猜想)猜想一:Cl-能促进金属铝与H+的反应。
猜想二:_____。
猜想三:铝表面的致密氧化膜有保护作用,使H+与铝不易接触。
为了验证上述假设,经充分讨论,大家设计了如下实验方案进行验证。
(查阅资料)已知 9.8%H2SO4 溶液和 7.3%HCl 溶液中 H+浓度相同。
(设计实验)
① | 9.8%H2SO4溶液5mL+铝片 | 不加其他试剂(对比) | 无气泡 |
② | 9.8%H2SO4溶液5mL+铝片 | 加入_____溶液 | 有较多气泡 |
③ | 9.8%H2SO4溶液5mL+铝片 | 加入 0.5mL Na2SO4 溶液 | 无气泡 |
④ | 7.3%HCl 溶液 5mL+铝片 | 加入_____溶液 | 有较多气泡 |
⑤ | 7.3%HCl 溶液 5mL+铝片 | 不加其他试剂(对比) | 有较多气泡 |
由实验②③得出猜想_____成立;由④⑤得出猜想_____不成立。为了验证猜想一成立,小明认为只需要在 5mL 9.8%H2SO4 溶液和铝片中加入_____,并与实验①对比即可。
(实验拓展)对于有气体生成的化学反应,我们可以用产生气体的速率来比较反应速率。为准确比较,应该测量收集相同体积气体所需的_____,因此,上述收集氢气应该采用_____法。
为了真实地观察未打磨的铝片与稀盐酸反应的情况,小红用压强传感器测量集气瓶中气体压强的变化,如图所示。
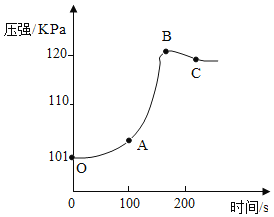
请解释曲线变化的原因:
OA 段_____;AB 段_____;BC 段_____。指出反应结束并恢复到常温时集气瓶内的压强值约为_____kpa。