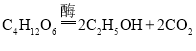题目内容
【题目】老师带领同学们探究铝和稀盐酸、稀硫酸的反应时发现:铝和稀盐酸剧烈反应,而和稀硫酸几乎不反应。
写出铝和稀盐酸反应的化学方程式_____。
[提出问题]铝和稀硫酸为什么几乎不反应?
[猜想与假设]猜想1:稀盐酸和稀硫酸中的氢离子浓度不同;
猜想2:盐酸中的氯离子对反应起了促进作用;
猜想3:硫酸中的硫酸根离子对反应起了阻碍作用。
[进行实验]
实验序号 | 实验操作 | 实验现象 | 实验结论 |
① | _____ | _____ | 猜想1错误 |
② | 在两支试管中各加入5 mL氢离子浓度相等的稀硫酸,分别插入规格相同的打磨的铝丝。 向其中一支试管中加入1g NaCl晶体 | _____ | 猜想2正确; 猜想3错误 |
[实验反思]
有同学用浓盐酸代替氯化钠证明猜想2正确,他的错误之处是_____。
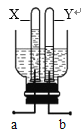
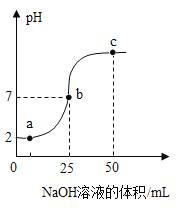
[实验解释]老师带领同学们利用数字化手持技术探究金属铝和稀盐酸反应时容器内压强和温度随时间变化的关系(如图)。
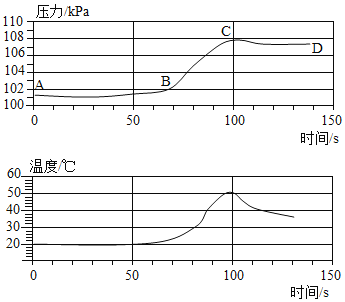
由图可知,_____(填字母序号)点时铝和稀盐酸反应完全。
(1) 0~50s内AB段压强变化不明显,原因可能是_____。
(2) BC段压强明显上升的主要原因是_____。
(3) CD段压强下降的原因是_____。
【答案】![]() 在两支试管中各加入体积相同,氢离子浓度不相等的稀硫酸,分别插入规格相同的打磨的铝丝 铝和不同浓度稀硫酸均几乎不反应(合理即可) 加入NaCl晶体的稀硫酸中反应剧烈,未加入的几乎不反应 将导致两组实验中氢离子的浓度差别较大,不能排除氢离子浓度对反应快慢的干扰 C 铝和空气中的氧气反应会生成氧化铝薄膜,盐酸会先与氧化铝反应生成氯化铝和水 铝和稀盐酸反应生成大量的氢气 反应结束后,随着热量的散失,压强逐渐变小(合理即可)
在两支试管中各加入体积相同,氢离子浓度不相等的稀硫酸,分别插入规格相同的打磨的铝丝 铝和不同浓度稀硫酸均几乎不反应(合理即可) 加入NaCl晶体的稀硫酸中反应剧烈,未加入的几乎不反应 将导致两组实验中氢离子的浓度差别较大,不能排除氢离子浓度对反应快慢的干扰 C 铝和空气中的氧气反应会生成氧化铝薄膜,盐酸会先与氧化铝反应生成氯化铝和水 铝和稀盐酸反应生成大量的氢气 反应结束后,随着热量的散失,压强逐渐变小(合理即可)
【解析】
铝和稀盐酸反应生成氯化铝和氢气,该反应的化学方程式为:![]() ;
;
进行实验:①实验结论为:猜想1错误,故实验应验证不同浓度的稀硫酸与铝反应,实验步骤:在两支试管中各加入体积相同,氢离子浓度不相等的稀硫酸,分别插入规格相同的打磨的铝丝,实验现象:铝和不同浓度稀硫酸均几乎不反应,可说明猜想1错误;
②实验结论为:猜想2正确,猜想3错误,实验步骤:在两支试管中各加入5 mL氢离子浓度相等的稀硫酸,分别插入规格相同的打磨的铝丝。 向其中一支试管中加入1g NaCl晶体,猜想2正确,猜想3错误,说明氯离子对反应起了促进作用,故实验现象为:加入NaCl晶体的稀硫酸中反应剧烈,未加入的几乎不反应;
实验反思:用浓盐酸代替氯化钠,将导致两组实验中氢离子的浓度差别较大,不能排除氢离子浓度对反应快慢的干扰;
实验解释:由图可知,C点时,压强最大,温度达到最高值,故C点时铝和稀盐酸反应完全;
(1)0~50s内AB段压强变化不明显,原因可能是:铝和空气中的氧气反应会生成氧化铝薄膜,盐酸会先与氧化铝反应生成氯化铝和水;
(2)BC段压强明显上升的主要原因是:铝和稀盐酸反应生成氢气,使压强增大;
(3)CD段压强下降的原因是:铝与稀盐酸反应放热,反应结束后,随着热量的散失,压强逐渐变小。

【题目】阅读下面科普短文
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。 它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护 地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。生产中大量使用的臭氧通常由以下方法制得。
臭氧处理饮用水。早在 19 世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的 15 倍之多。臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表 1 所示。
表 1臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2mg/L) | 二次污染 | 投资成本 | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | <5min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | >30min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题:
(1)写出臭氧的一点物理性质_________。
(2)处理饮用水利用了臭氧的_____(填”物理”或”化学”)性质。
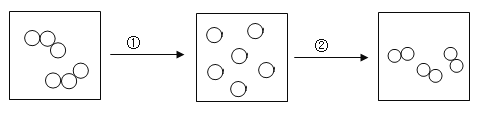
(3)臭氧转化为氧气的微观示意图如下图所示,其反应的微观实质是①_____,②______。
(4)为了快速杀灭病毒,应选择的消毒剂是_____。
(5)下列关于臭氧的说法中,正确的是_____。
A臭氧的漂白作用比氯气强
B由氧气制得臭氧的过程中,既有物理变化也有化学变化
C臭氧稳定性差,不利于储存,其应用可能会受到限制