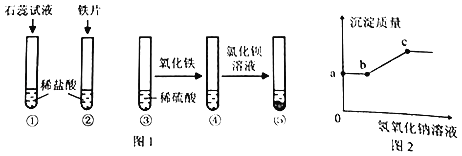
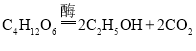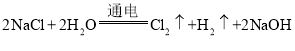题目内容
【题目】金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)常用铜做导线,是因为铜的__________性好。
(2)路边的太阳能路灯灯柱为铝合金材质。铝合金灯柱硬度比纯铝__________ (填“大” 或“小”)。
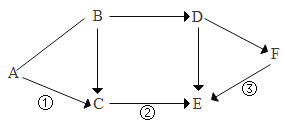
(3)金属的回收不仅节约资源和能源,还能减少对环境的污染。某化学实验室从含少量硝酸锌的硝酸银废液中提取贵金属Ag,其主要操作流程如图:
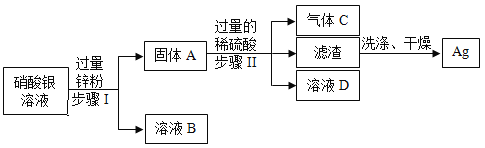
①固体A的成分有_______________。
②步骤I中发生的化学反应方程式____________________。
③步骤Ⅰ、Ⅱ共同的实验操作名称是_____________,若往溶液D中加入适量某物质后,可得到只含一种溶质的溶液。则该反应的化学方程式为_________________。
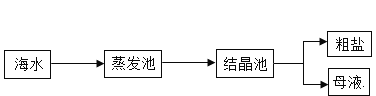
(4)目前世界上60%的镁单质是从海水中提取的,已知海水提镁的主要步骤如下:
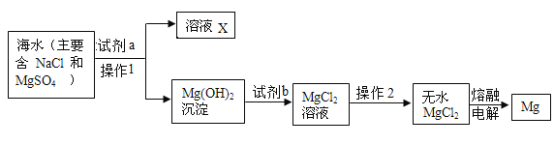
①操作2中玻璃棒的作用是_______________。
②下列说法正确的是____________________。
A加入的试剂a为石灰乳,试剂b为稀盐酸
B向溶液X中加入硝酸银溶液,若产生白色沉淀,则海水中的氯化镁没有完全转化为沉淀
C上述过程中一共涉及了三种基本反应类型
③海水中本来已有氯化镁,为什么人们还要通过上述过程获得氯化镁?请简述原因_________________。
【答案】导电性和延展性 大 银和锌 ![]() 过滤
过滤 ![]() 搅拌,防止局部温度过高,造成液滴飞溅 A 富集氯化镁,使获得氯化镁更纯净
搅拌,防止局部温度过高,造成液滴飞溅 A 富集氯化镁,使获得氯化镁更纯净
【解析】
(1)常用铜做导线,是因为铜的导电性和延展性好;
(2)铝合金灯柱硬度比纯铝大;
(3)①加入过量锌粉,锌与硝酸银反应生成硝酸锌和银,故固体A的成分有银和过量的锌;
②步骤I中发生的反应为锌与硝酸银反应生成硝酸锌和银,化学反应方程式为:![]() ;
;
③步骤Ⅰ、Ⅱ都实现了固液分离,故共同的实验操作名称是:过滤;
固体A含银和锌粉,加入过量稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,故溶液D中含硫酸锌和稀硫酸,加入过量锌,使锌与过量的稀硫酸反应生成硫酸锌和氢气,得到只含一种溶质的溶液,则该反应的化学方程式为:![]() ;
;
(4)①操作2为蒸发,玻璃棒的作用是:搅拌,防止局部温度过高,造成液滴飞溅;
②A、由流程图可知,加入试剂a有氢氧化镁生成,故加入的试剂a为石灰乳,氢氧化钙与硫酸镁反应生成氢氧化镁沉淀和硫酸钙,加入试剂b,氢氧化镁沉淀变为氯化镁,故b为稀盐酸,氢氧化镁与稀盐酸反应生成氯化镁和水,符合题意;
B、溶液X中含氯化钠,氯化钠也能和硝酸银反应生成氯化银沉淀,不能说明海水中的氯化镁没有完全转化为沉淀,不符合题意;
C、上述过程中涉及到的反应有:![]() ,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
![]() ,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
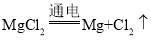 ,该反应符合“一变多”的特点,属于分解反应。故一共涉及了两种基本反应类型,不符合题意。
,该反应符合“一变多”的特点,属于分解反应。故一共涉及了两种基本反应类型,不符合题意。
故选A。
③海水中含有的氯化镁浓度较低,通过以上过程获得氯化镁是为了富集氯化镁,使获得氯化镁更纯净。