题目内容
【题目】人类社会的文明进步与金属材料的发展关系密切。
(1)钢铁是应用最普遍的金属材料,容易与空气中的______等物质共同作用而生锈,给人们造成巨大的经济损失。生锈的铁制品在稀硫酸中短时间浸泡,就可以除去金属表面的铁锈,请写出除锈过程中的实验现象______。写出该化学方程式______。
(2)黄金能压制成金箱,主要是利用了黄金具有良好的______性。
(3)废液中含有少量的硝酸银和硝酸铜。取一定量的废液,加入一定质量的铁粉,充分反应后过滤,得到滤渣和滤液。向滤渣中加入稀盐酸,有气泡产生。
①滤渣中一定含有的金属是_____。
②硝酸铜溶液和铁反应的化学方程式为_______。
(4)除去ZnSO4溶液中少里CuSO4杂质,下列试剂中最好的是_____。
A NaOH溶液
B Fe
C CuO
D Zn
【答案】O2和H2O 铁锈逐渐消失,溶液由无色变为黄色 ![]() 延展性 Ag、Cu、Fe Fe+Cu(NO3)2=Fe(NO3)2+Cu D
延展性 Ag、Cu、Fe Fe+Cu(NO3)2=Fe(NO3)2+Cu D
【解析】
(1)钢铁是应用最普遍的金属材料,容易与空气中的氧气和水等物质共同作用而生锈,给人们造成巨大的经济损失。生锈的铁制品在稀硫酸中短时间浸泡,就可以除去金属表面的铁锈,除锈过程中的实验现象:铁锈逐渐消失,溶液由无色变为黄色。氧化铁与稀硫酸反应产生硫酸铁和水的化学方程式![]() 。
。
(2)黄金能压制成金箱,主要是利用了黄金具有良好的延展性,可以发生形变。
(3)废液中含有少量的硝酸银和硝酸铜。取一定量的废液,加入一定质量的铁粉,充分反应后过滤,得到滤渣和滤液。向滤渣中加入稀盐酸,有气泡产生,说明铁粉过量,铁与稀盐酸反应产生氢气,同时铁已经将银离子和铜离子全部置换完全。
①滤渣中一定含有的金属是:Ag、Cu、Fe;
②硝酸铜溶液和铁反应产生硝酸亚铁和铜的化学方程式为Fe+Cu(NO3)2=Fe(NO3)2+Cu。
(4)除去ZnSO4溶液中少里CuSO4杂质,最好选用:
A、氢氧化钠能与硫酸锌、硫酸铜都反应,有效成分被除去;故选项错误;
B、铁能与硫酸铜溶液反应产生硫酸亚铁和铜,引入新杂质亚铁离子;故选项错误;
C、氧化铜不能与硫酸铜反应,不能用于除杂;故选项错误;
D、锌能与硫酸铜反应产生硫酸锌和铜,过滤后,溶液中只含有硫酸锌;
故选:D。

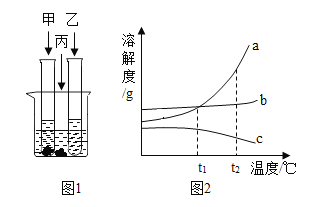
【题目】某化学兴趣小组的同学在探究金属的有关性质时,进行了如图所示实验:在A实验结束后将两支试管内的物质倒入一洁净烧杯中,一段时间后过滤 。为确定过滤后得到的滤渣和滤液的成分,同学们进行了如下实验。
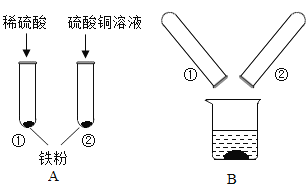
实验一:滤渣的成分是什么?
(1)甲同学取少量滤渣于试管中,加入稀硫酸,无气泡产生,证明滤渣里不含_________,乙同学通过物理方法也得到同样的结论,请简述其方法和现象:_________。
实验二:滤液里的溶质有哪些?
(2)同学们一致认为定有FeSO4,为确定可能含有其他溶质,同学们进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取少量滤液,向其中加入足量铝粉 | 产生气泡,并有红色固体析出 | 滤液里的溶质还有_______ |
请写出产生气泡反应的化学方程式:_________。
(3)有同学提出可以直接观察滤液的颜色判断滤液中是否含有硫酸铜,同学们对硫酸铜溶液为什么呈蓝色很感兴趣,决定探究硫酸铜溶液中哪种粒子使溶液呈蓝色。设计的实验方案如下:
实验操作 | 实验现象 | 实验结论 |
①取少量_______溶液,观察颜色 | 溶液呈无色 | 硫酸根离子不能使溶液呈蓝色 |
②取少量硫酸铜溶液,观察颜色 | 溶液呈蓝色 | 铜离子使溶液呈蓝色 |
(4)除了(3)中的实验方案外,你还能设计其他方案探究硫酸铜溶液中是铜离子使溶液呈蓝色吗?实验所需的药品和仪器任选,请简述实验操作和实验现象。
实验操作:___________。
实验现象:____________。
【题目】利用物质的性质能帮助我们开展科学探究。
[认识物质]
俗名 | 所含原子团 | 用途 | |
氢氧化钠 | _________、 火碱、苛性钠 | 氢氧根 | 精炼石油等 |
碳酸钠 | 纯碱、苏打 | ____ | 生产玻璃制品等 |
[定性检测]
为检测久置空气中的氢氧化钠是否变质,设计并进行了如下图的实验:
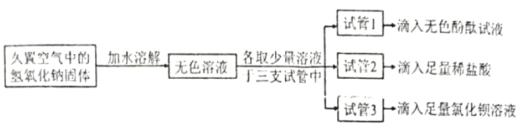
①试管1中观察到的现象是__________。
②试管2中观察到产生气泡,反应的化学方程式为___________。
③试管3中观察到产生__________。
④能达到实验目的的是试管__________(选填“1”、 “2”或“3”) 中的实验。
⑤若要判断氢氧化钠是部分变质还是全部变质,请你选择上述实验后三支试管中的液体继续实验,完成下表。
试管的编号 | 实验操作 | 现象和结论 |
试管________(选填“1”、“2”或“3”) | ____ | ____ |
[定量测定]
为了测定ag变质氢氧化钠中碳酸钠的质量分数,设计了如下的实验方案(浓硫酸具有吸水性):
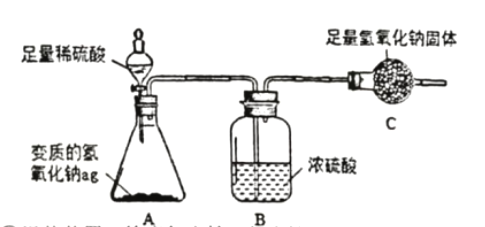
实验步骤和数据:①组装装置,检查气密性(气密性良好);②加入药品,称量C处装置质量为bg,滴入足量稀硫酸;③完全反应后称暈C处装置质量为cg;④后续处理。
实验分析:
I.判断碳酸钠已完全反应的实验现象是____________________。
II.利用实验数据,可得变质氢氧化钠中碳酸钠的质量分数为____________(用字母表示)。
Ⅲ.所得实验结果存在一定的误差, 可能的原因是_____________(写出一点即可)。