题目内容
【题目】利用物质的性质能帮助我们开展科学探究。
[认识物质]
俗名 | 所含原子团 | 用途 | |
氢氧化钠 | _________、 火碱、苛性钠 | 氢氧根 | 精炼石油等 |
碳酸钠 | 纯碱、苏打 | ____ | 生产玻璃制品等 |
[定性检测]
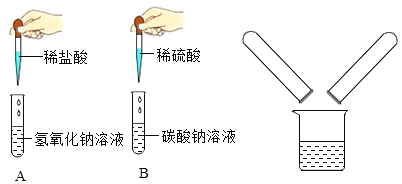
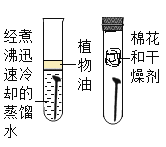
为检测久置空气中的氢氧化钠是否变质,设计并进行了如下图的实验:
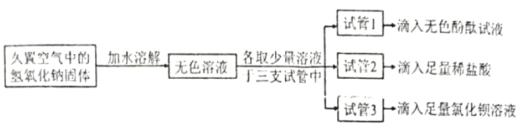
①试管1中观察到的现象是__________。
②试管2中观察到产生气泡,反应的化学方程式为___________。
③试管3中观察到产生__________。
④能达到实验目的的是试管__________(选填“1”、 “2”或“3”) 中的实验。
⑤若要判断氢氧化钠是部分变质还是全部变质,请你选择上述实验后三支试管中的液体继续实验,完成下表。
试管的编号 | 实验操作 | 现象和结论 |
试管________(选填“1”、“2”或“3”) | ____ | ____ |
[定量测定]
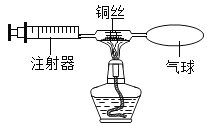
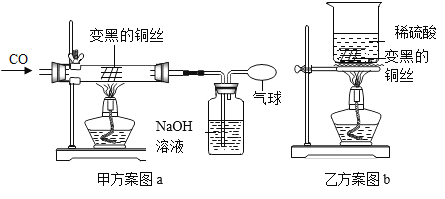
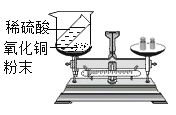
为了测定ag变质氢氧化钠中碳酸钠的质量分数,设计了如下的实验方案(浓硫酸具有吸水性):
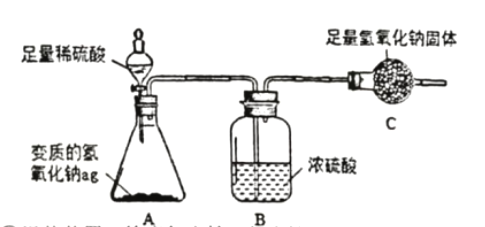
实验步骤和数据:①组装装置,检查气密性(气密性良好);②加入药品,称量C处装置质量为bg,滴入足量稀硫酸;③完全反应后称暈C处装置质量为cg;④后续处理。
实验分析:
I.判断碳酸钠已完全反应的实验现象是____________________。
II.利用实验数据,可得变质氢氧化钠中碳酸钠的质量分数为____________(用字母表示)。
Ⅲ.所得实验结果存在一定的误差, 可能的原因是_____________(写出一点即可)。
【答案】烧碱 碳酸根 溶液由无色变成红色 ![]() 产生白色沉淀 2、3 3 取反应后的液体于试管中,滴入无色酚酞试液 若溶液变红,则说明部分变质;若溶液不变色,则说明全部变质 加入稀硫酸后,气泡不再产生
产生白色沉淀 2、3 3 取反应后的液体于试管中,滴入无色酚酞试液 若溶液变红,则说明部分变质;若溶液不变色,则说明全部变质 加入稀硫酸后,气泡不再产生 ![]() 空气中的水和二氧化碳可能会进入C中
空气中的水和二氧化碳可能会进入C中
【解析】
[认识物质]氢氧化钠又可成为烧碱;碳酸钠含有原子团为碳酸根;
故答案为:烧碱;碳酸根。
[定性检测]①、氢氧化钠和碳酸钠溶液都显碱性,加入酚酞后,溶液变红;
故答案为:溶液由无色变成红色。
②、产生气泡,说明有碳酸钠存在,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,据此书写化学方程式;
故答案为:![]() 。
。
③、由于试管2验证了碳酸钠的存在,所以碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,此时可以看到白色沉淀;
故答案为:产生白色沉淀。
④、实验目的是验证氢氧化钠是否变质,因此要验证碳酸钠的存在,所以通过实验能得出存在碳酸钠就可以达到实验目的,实验1只能说明显碱性,不能说明有碳酸钠,实验2和实验3可以通过观察气泡和沉淀,判断碳酸钠的存在,因此可以达到实验目的;
故答案为:2、3。
⑤、氢氧化钠和碳酸钠溶液都显碱性,实验1加入指示剂酚酞后,溶液都变红,无法判断,设计实验时还需要验证氢氧化钠和碳酸钠两者;实验2加入了足量盐酸,反应后溶质为氯化钠和盐酸,无法验证;实验3加入足量氯化钡,与碳酸钠反应生成了碳酸钡的白色沉淀,若有氢氧化钠剩余,则溶液显碱性,因此只要验证氢氧化钠存在即可,所以选择实验3进行验证;此时实验3试管内碳酸钠全部消耗完毕,此时溶液内不存在碳酸钠了,一定有生成的氯化钠,此时若加入酚酞,溶液显红色,说明溶液显碱性,证明氢氧化钠存在,氢氧化钠只是发生了部分变质;若不变色,则氢氧化钠全部变质;
故答案为:3;取反应后的液体与试管中,滴入无色酚酞试液;若溶液变红,则说明部分变质;若溶液不变色,则说明全部变质。
[定量测定] Ⅰ、硫酸与碳酸钠反应会生成二氧化碳,因此在浓硫酸中会形成气泡,通过观察是否还有气泡产生,判断碳酸钠是否全部反应;
故答案为:加入稀硫酸后,气泡不再产生。
Ⅱ、C装置吸收二氧化碳,因此增加质量为生成二氧化碳质量,根据碳原子质量守恒,碳酸钠中碳原子质量=二氧化碳中碳原子质量,设碳酸钠质量为m,
![]()
![]() ,所以碳酸钠质量分数=
,所以碳酸钠质量分数= ![]() ;
;
故答案为:![]() 。
。
Ⅲ、氢氧化钠直接接触了空气,由于空气中存在二氧化碳和水蒸气,会被氢氧化钠吸收,增加了质量,造成测得数据偏大;
故答案为:空气中的水和二氧化碳可能会进入C中。

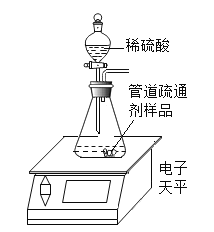
【题目】小美网购了一种管道疏通剂, 其主要成分是氢氧化钠和碳酸钠中的一种或两种。小美和兴趣小组同学对这种管道疏通剂的成分进行了探究:
[提出问题]该管道疏通剂的成分是什么?
[猜想]猜想一:碳酸钠;
猜想二:氢氧化钠;
猜想三:氢氧化钠和碳酸钠。
[设计与实验] (假设管道疏通剂中其他成分不影响其主要成分的检测)
本次实验所需试剂只能从下列试剂中选择:蒸馏水,澄清石灰水、氯化钡溶液、稀盐酸、 氯化铜溶液、酚酞溶液。
方案 | 操作 | 现象 | 结论 |
一 | 取一包装良好的管道疏通剂,拆开包装,取样于试管中,加水溶解,滴入澄清石灰水 | 出现白色沉淀 | 猜想一正确,反应的化学方程式为__________ |
二 | 取一包装良好的管道疏通剂,拆开包装,取样于试管中,加入适量的水溶解,再滴加足量的________溶液后,取上层清液滴入酚酞试液 | ____________ | 猜想三正确 |
[讨论]小组同学认为方案一的结论不严谨, 理由是_________________。
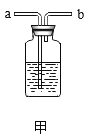
[拓展](1)结合上述探究分析,这种管道疏通剂不能与皮肤接触,其原因是_____________。
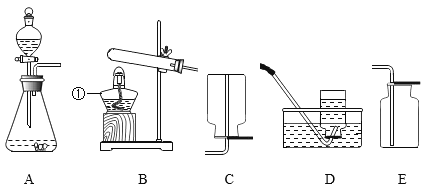
(2)为定量测定这种管道疏通剂中碳酸钠的含量,小美设计如图所示实验,小江认为实验时不用检查装置气密性,你同意小江的观点吗?并说明理由______________________。